1、填空题 (10分)下图是元素周期表的框架图(未标出元素周期表的边界),请根据下面提问回答表中指定元素的相关问题:
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ①
| ②
| ?
| ③
| ?
|
?
| ④
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为??。
(2)表中能形成两性氢氧化物的元素是??(用元素符号表示),写出该两性氢氧化物与⑦的氢化物的水溶液反应的离子方程式??。
(3)电子式表示④与⑦形成化合物的过程??。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是??
?(填酸的化学式)。
(5)⑥、⑦、⑨电子数相等的简单离子的半径由大到小依次为?(用元素符号表示)。
(6)④⑤两元素相比较,金属性较强的是?(填名称),可以验证该结论的实验是?(填编号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
参考答案:(10分) (1) 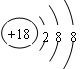 ?(2) Al? , Al(OH)3 + OH- = AlO2- +2H2O
?(2) Al? , Al(OH)3 + OH- = AlO2- +2H2O
(3)  ?
?
(4) HClO4?(5) S2- >Cl->K+?(6) 镁,? bc
本题解析:考查元素周期表都结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br。
(1)中化学性质最不活泼的元素是稀有气体Ar,其原子结构示意图为 。
。
(2)表中能形成两性氢氧化物的元素是Al,氢氧化铝能溶于盐酸中,方程式为Al(OH)3 + OH- = AlO2- +2H2O。
(3)镁和氯气形成的是离子键,其形成过程为
 。
。
(4)非金属性越强,最高价氧化物的水化物中酸性。由于F没有含氧酸,所以应是高氯酸。
(5)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以顺序是S2- >Cl->K+。
(6)镁的金属性强于铝的。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
所以答案选bc。
本题难度:一般
2、填空题 A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
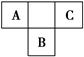
(1)写出A、B、C三元素名称______、______、______。
(2)C在元素周期表中的位置是_____________________________________。
(3)B的原子结构示意图为________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径:A________C,写出A的气态氢
化物与A的最高价氧化物对应水化物反应的化学方程式:___________________________。
参考答案:(1)氮 硫 氟 (2)第2周期ⅦA族? (3) 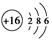 HF H2S
HF H2S
(4)> NH3+HNO3===NH4NO3
本题解析:据A、B、C在周期表中的位置可知,A、C处于第二周期,B处于第三周期,设B的原子序数为x,则A为x-9,C为x-7,据题意有x-9+x-7=x,则x=16,又由于B原子核内质子数和中子数相等,则B的中子数为16,即为S,那么A为N,C为F。
本题难度:一般
3、填空题 (本题共12分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3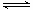 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压? b.增加NH3的浓度? c.升温? d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
参考答案:(1)bc?(2)2NH3+CO2+H2O→(NH4)2CO3、(NH4)2CO3+CO2+H2O→2NH4HCO
(3)①低温加压下吸收CO;②然后将铜液洗涤转移至另一容器中;③高温低压下释放CO,然后将铜洗液循环利用。
(4)C>N>O>H;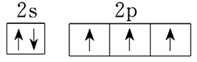 ;NH3和PH3的稳定性
;NH3和PH3的稳定性
(5)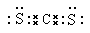 ;CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
;CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
本题解析:(1)降低压强,反应速率减小,a不正确;增加NH3的浓度或升高温度,反应速率均增大bc正确;及时移走产物,即降低生成物浓度,反应速率也减小,d不正确,答案选bc。
(2)氨气是碱性气体,CO2是酸性气体,二者反应的化学方程式为2NH3+CO2+H2O→(NH4)2CO3、(NH4)2CO3+CO2+H2O→2NH4HCO3。
(3)根据Cu(NH3)2Ac+CO+NH3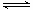 [Cu(NH3)3CO]Ac可知,该反应是体积减小的放热的可逆反应,因此吸收CO的适宜条件是低温加压下吸收CO。若要再生,则只需要将铜液洗涤转移至另一容器中;然后高温低压下释放CO,最后将铜洗液循环利用即可。
[Cu(NH3)3CO]Ac可知,该反应是体积减小的放热的可逆反应,因此吸收CO的适宜条件是低温加压下吸收CO。若要再生,则只需要将铜液洗涤转移至另一容器中;然后高温低压下释放CO,最后将铜洗液循环利用即可。
(4)铜液的组成元素中属于短周期元素的是H、C、N、O,同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则四种元素的原子半径大小顺序是C>N>O>H;氮元素原子最外层有4个电子,根据核外电子排布规律可知,最外层电子排布的轨道表达式是 。非金属性越强,氢化物的稳定性越强,因此可通过比较NH3和PH3的稳定性判断氮、磷两种非金属元素的非金属性强弱。
。非金属性越强,氢化物的稳定性越强,因此可通过比较NH3和PH3的稳定性判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,则根据CO2的电子式可得CS2的电子式是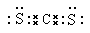 。CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大,因此CS2熔点高于CO2。
。CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大,因此CS2熔点高于CO2。
本题难度:一般
4、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/pm
| 160
| 143
| 70
| 66
|
主要化合价
| +2
| +3
| +5、+3、-3
| -2
|
?
下列叙述正确的是(?)
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
参考答案:D
本题解析:此题考查了物质结构与元素周期律知识。先判断出各元素在周期表中的位置如下表:
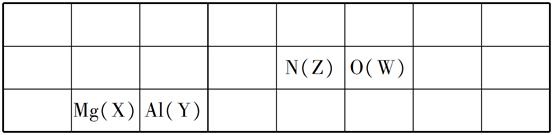
判断思路:先确定W为8O;Z为ⅤA族,因Z与W原子半径相近,应为同周期——Z为7N;X为ⅡA族、Y为Ⅲ族,二者原子半径相近,应为同周期,应该为12Mg、13Al,原因有二:一是通常考查的是常见元素(出现Be、B的机率小),二是原子半径比Z(7N)大的多,同周期的原子半径不会变化太大。据上表,金属性是Mg(X)>Al(Y),A项错误。B项,N2与O2反应生成NO,不能一步生成NO2,B项错。Y(Al)的最高价氧化物的水化物是Al(OH)3,不溶于氨水,C项错。NH3+O2―→N2+H2O,该反应能发生,D项对。
本题难度:一般
5、选择题 下列叙述中,正确的是(?)
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了K层后才排L层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
参考答案:B
本题解析:A项:在多电子的原子里,能量高的电子通常在离核远的区域内活动;C项:比如Na+与O2+核外电子排布相同,但其化学性质却完全不同;D项:氦原子的最外层2电子也是稳定结构。
本题难度:一般