1、选择题 有一种保健食品含有人体所必须的硒元素,有一定的保健作用,已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述不正确的是(?)
A.原子序数是24
B.最高价氧化物是SeO3,是酸性氧化物
C.原子半径比钙小
D.气态氢化物化学式是H2Se,稳定性比HCl差
参考答案:A
本题解析:硒元素与氧、硫元素同主族,依据元素周期律,可得硒的原子序数是34,故A不正确;参照硫元素,可知硒的最高价氧化物是SeO3,是酸性氧化物,气态氢化物化学式是H2Se,氯元素的非金属性比硒强,所以稳定性比HCl差,故B、D正确;硒元素与钙元素同周期,原子半径从左到右逐渐减小,故C正确。
点评:本题考查元素周期表中元素性质递变规律及元素周期律,题目难度不大。
本题难度:简单
2、填空题 ①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:?
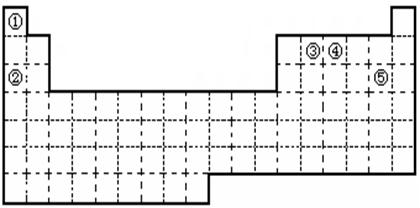
(1)①②③④⑤五种元素中,金属性最强的元素是?(写元素名称), 该元素的单质在空气中燃烧的化学方程式为? ?。
(2)元素②的最高价氧化物对应的水化物属于?化合物,(填“共价”或“离子” ),其电子式为 ?, 试比较②和③原子半径的大小
②?③(填“﹥” 或“﹤” )
(3)画出元素④的原子结构示意图?,该元素的最高价氧化物的
水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)?。
(4)写出元素⑤在周期表中的位置?,以海水中含量最大的物质为原料可以生产⑤的单质,同时还可以得到另外两种重要的工业原料,该反应的化学方程式为? ?。
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍。
①甲、乙元素分别为??、 ?(写元素名称)
②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式??
参考答案:(1) 钠 (1分)?2Na + O2  ?Na2O2(2分)
?Na2O2(2分)
(2) 离子?电子式略?﹥?(各1分)?
电解
?(3)?略,? HNO3(各1分)?(4) 第三周期ⅦA 族 (1分)2NaCl +2H2O =Cl2↑+H2↑+2NaOH(2分)
(5)①铝、镁(各1分)?
②2NaOH+Al2O3=2Na AlO2+H2O(2分)
本题解析:根据元素所在周期表中的位置可知:①为H元素,②为Na元素,③为C元素,④为N元素,⑤为Cl元素。
(1)同周期中元素的金属性从左到右逐渐减弱,同主族元素的金属性从上到下逐渐增强,则金属性最强为Na,在氧气中燃烧的化学方程式为2Na + O2  ?Na2O2。
?Na2O2。
(2)元素②的最高价氧化物对应的水化物为NaOH,为离子化合物,电子式为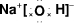 ,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故②>③;
,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故②>③;
(3)④为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为 ,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂。
,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂。
电解
?(4)⑤为Cl元素,原子核外有3个电子层,最外层电子数为7,所以在第三周期ⅦA族,电解饱和食盐水的产物为氢氧化钠、氢气和氯气,反应的方程式为2NaCl+2H2O=Cl2↑+H2↑+2NaOH。(5)①甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,发生钝化反应,应为铝单质,乙元素原子核外L层电子数是M层电子数的4倍,应为镁元素,故答案为:铝;镁;②的最高价氧化物对应的水化物与甲的最高价氧化物的反应为氢氧化钠和氧化铝的反应,氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,反应的化学方程式为
2NaOH+Al2O3=2NaAlO2+H2O。
点评:本题考查较为综合,涉及元素的推断、元素周期律、氧化还原反应、电解以及化学反应与能量等问题,题目难度中等,注意正确把握元素周期律的递变规律以及相关基础之知识的积累.
本题难度:一般
3、选择题 短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是(? )
A.若XY2是共价化合物,则X与Y的原子序数可能相差1
B.若XY2是离子化合物,则X与Y的原子序数可能相差8
C.若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小
D.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
参考答案:B
本题解析:A正确,例如NO2符合;若XY2是离子化合物,则X与Y的原子序数不可能相差8,B不正确;C正确,此时化合物是氯化镁;D正确,此时该化合物是二氧化硅,答案选B。
点评:该题是中等难度的试题,也是高考中的常见考点和题型。试题注重基础,侧重能力的培养和训练。有助于培养学生的逻辑推理能力和灵活应变能力。该题学生需要掌握通过举例逐一进行筛选得出正确结论的解题方法。
本题难度:一般
4、填空题 (12分)甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):

试回答:
(1)甲元素的名称为?,溴元素在周期表的位置?丁元素的阴离子结构示意图为?。
(2)A的电子式为?;所含化学键类型为?。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)?。
(4)反应(I)的化学方程式为?。
(5)反应(II)的离子方程式为?。
参考答案:(共12分) (1)氢(1分),第四周期ⅦA族(1分), (1分)
(1分)
(2) ?(1分),离子键和共价键(2分)
?(1分),离子键和共价键(2分)
(3)S2->O2->Na+(2分)
(4) 2Na2O2+2H2O=4NaOH+O2↑(2分)
(5)SO2+Br2+2H2O=4H+ + SO42--+ 2Br-(2分)
本题解析:略
本题难度:简单
5、选择题 关于SO2分子与CO2分子说法正确的是
A.均为非极性分子
B.中心原子都采取sp杂化轨道
C.S原子和C原子上都没有孤对电子
D.SO2为V形结构,CO2为直线形结构
参考答案:D
本题解析:A不正确,SO2是V形结构。B不正确,SO2中中心原子是sp3杂化,CO2中中心原子是sp杂化。C不正确,S原子含有1对孤对电子,所以正确的答案选D。
本题难度:一般