1、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
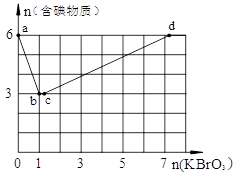
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 ________________________________________。
(3)n(KBrO3) = 4时,对应含碘物质的化学式为 。
参考答案:(1)1 : 6;(2)BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O(3)I2,KIO3;
本题解析:(1)b点时,KI反应完全,n(KI):n(KBrO3)=6:1,反应中KI被氧化,KBrO3被还原,反应的方程式为6I-+BrO3-+6H+=3I2+Br-+3H2O,
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3,
考点:本题综合考查氧化还原反应
本题难度:困难
2、选择题 用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀NaOH溶液,要消耗OH-,故溶液的pH减小
C.电解Na2SO4溶液,在阴极和阳极上析出产物的物质的量之比为1∶2
D.电解CuCl2溶液,在阴极和阳极上析出产物的物质的量之比为1∶1
参考答案:D
本题解析:试题分析:电解稀硫酸溶液,实质上是电解水,水少了,氢离子浓度要增大故A错误;电解稀氢氧化钠溶液,实际是电解水,氢氧根浓度增大,PH要增大,故B错误;电解硫酸钠溶液,实际是电解水,阳极产生氧气,阴极产生氢气,阴极上和阳极上析出产物的物质的量之比为2:1,因此C也错误;电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1,其中阴极产生Cl2,阳极生成铜,选D正确。
考点:溶液电解的概念及分析阴阳极上产物的物质的量
点评:本道题是考查溶液电解基础题,理解电解的概念及阴阳极上反生的离子方程式,是做题的关键。
本题难度:一般
3、选择题 NO2被水吸收的过程中,发生了氧化还原反应3NO2+ H2O ="==" 2HNO3+ NO,其中被氧化的N和被还原的N的物质的量之比是
A.3