|
高考化学试题《反应速率与平衡的有关计算》典型例题(八)
2019-06-25 23:15:49
【 大 中 小】
|
1、填空题 如图表示某温度时,反应N2O4(g) 2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。 2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。
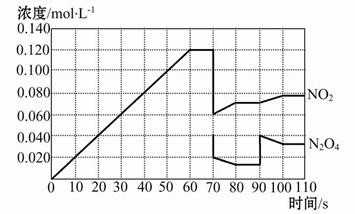
(1)该可逆反应达到平衡的时间段为?。
(2)反应进行到70 s时,改变的条件可能是?(填字母,下同),反应进行到90 s时,改变的条件可能是?。
A.加入催化剂
B.扩大容器体积
C.升高温度
D.增大N2O4的浓度
| (3)90 s后若维持容器的体积不变,平衡移动的方向为?(填“正反应”、“逆反应”或“不移动”),此时N2O4的转化率?(填“增大”、“减小”或“不变”)。
(4)请在图中画出反应物N2O4在0~70秒时的浓度变化曲线。
参考答案:(1)60~70 s、80~90 s、100~110 s? (2)B? D
(3)正反应?减小
(4)
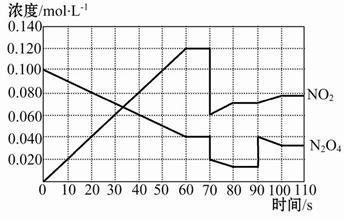
本题解析:(1)由图像可知反应达到平衡的时间段为60~70 s、80~90 s和100~110 s。
(2)反应进行到70 s时改变某一条件,可以看出NO2的浓度迅速从0.120 mol·L-1减小到0.060 mol·L-1,N2O4的浓度从0.040 mol·L-1减小到0.020 mol·L-1,两者的浓度都减小到原来的1/2,说明改变的条件为增大容器的体积为原来的2倍或减小压强为原来的1/2;90 s时突然改变某一条件可以看出NO2的浓度瞬间没有改变,但是N2O4的浓度瞬间增大,说明改变的条件是增大了N2O4的浓度。
(3)根据(2)可知,90 s后平衡向正反应方向移动;增大N2O4的浓度,在恒容容器中相当于增大压强,则N2O4的转化率减小。
(4)从图像可知,NO2为反应物,N2O4为生成物。60 s达到平衡时NO2的浓度增大了0.120 mol·L-1,说明N2O4反应过程中浓度减少了0.060 mol·L-1,因为已知在70 s时N2O4的浓度为0.040 mol·L-1,所以N2O4的起始浓度为0.040 mol·L-1+
0.060 mol·L-1="0.100" mol·L-1。
本题难度:一般
2、选择题 将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa
体积分数/%
温度/℃
| 1.0
| 2.0
| 3.0
| 810
| 54.0
| a
| b
| 915
| c
| 75.0
| d
| 1000
| e
| f
| 83.0
|
?
①b<f?②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0?④K(1000℃)>K(810℃)
上述①~④中正确的有(? )
A.4个? B.3个? C.2个? D.1个
参考答案:A
本题解析:该反应的气体系数由1变为2,气体的物质的量增大,则?S>0,③正确;设E的初始物质的量为n,反应的物质的量为x,则生成G的物质的量为2x,平衡时G的体积分数为75.0%。可得2x/(n-x+2x)=75.0%,得x=0.6n,E的转化率为60%,故②正确;根据表中给出的三个体积分数可以看出,随着压强增大、温度升高,平衡时G的体积分数增大,而压强增大,化学平衡向逆反应方向移动,说明温度升高一定使平衡向正反应方向移动,正反应为吸热反应,④正确;f比b的温度高,压强小,使平衡向正反应方向移动,①正确。
【考点定位】本题考查温度、压强对化学平衡的影响、转化率的计算、?S的判断以及平衡常数的比较。
本题难度:简单
3、简答题 (16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示:
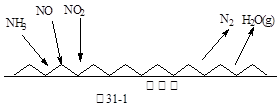 ? ?
①由图31-1可知SCR技术中的氧化剂为:?。
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为:?、?。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)=?。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为?。

(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l) H2SO3(l) H+(aq)+HSO3—(aq) ?I H+(aq)+HSO3—(aq) ?I
HSO3—(aq) H+(aq)+SO32—(aq)?II H+(aq)+SO32—(aq)?II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq)?III Ca2+(aq)+2OH—(aq)?III
Ca2+(aq)+SO32—(aq) CaSO3(s)?IV CaSO3(s)?IV
④步骤II的平衡常数K的表达式为?。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
参考答案:(1)① NO、NO2?(2分)?② Mn (2分)? 200-250℃或范围内间任意温度(2分)
③1:1 (2分)? 2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
(2) ④K=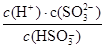 ?(2分) ?(2分)
⑤c(SO32-)=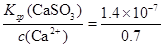 ?mol/L=2×10-7mol/L(3分) ?mol/L=2×10-7mol/L(3分)
本题解析:(1)①根据反应前后元素化合价变化可知,氨气中氮元素的化合价从-3价升高到0价,失去电子被氧化做还原剂;氮氧化合中氮元素的化合价降低,得到电子被还原做氧化剂,因此氧化剂是NO、NO2。
②根据图像可知,两种催化剂的脱氮率几乎是相同的,但Mn所在曲线的温度低,所以由图可知最佳的催化剂和相应的温度分别为Mn和200~250℃或范围内间任意温度。
③根据图像可知c(NO2)/c(NO)=1:1是脱氮率最高,由于每生成1molN2反应放出的热量为QkJ,所以此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol。 2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
(2) ④化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据化学方程式可知,该反应的平衡常数表达式K=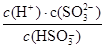 。 。
⑤根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)·c(SO32-)可知,c(SO32-)=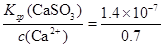 mol/L=2×10-7mol/L。 mol/L=2×10-7mol/L。
本题难度:一般
4、填空题 (10分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6)?②NaUr(s) Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6)?②NaUr(s)  Ur-(aq)+Na+(aq) Ur-(aq)+Na+(aq)
(1)37°时,1.0 L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L—1,其中尿酸分子的浓度为5.0×10—4mol·L—1,该病人尿液的c(H+)为??,PH?7(填“>”、“=”或“<”)。
参考答案:(共10分)
(1)6.4×10-5 ? (2)减小 放热? (3)1.33×10-6 mol·L-1 <
本题解析:略
本题难度:简单
5、选择题 在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的? CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的?
A.5.75倍
B.11.5倍
C.30.67倍
D.46倍
参考答案:B
本题解析:平衡混合气体与氢气的密度比就等于分子量比。此题的关

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的

为相同条件下H2密度为11.5倍。
本题难度:一般
|