1、选择题 在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g) 2Z(g)
2Z(g)
此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
2、选择题 在2A+B=3C+4D反应中,表示该反应速率最快的数据是
[? ]
A.υA = 0.5mol/(L·s)
B.υB = 0.3mol/(L·s)
C.υC = 0.8mol/(L·s)
D.υD = 1.0mol/(L·s)
3、填空题 (1)下列方法可以证明2HI(g)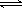 H2(g)+I2(g)已达平衡状态的是?
H2(g)+I2(g)已达平衡状态的是?
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)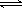 2SO3(g)。研究发现,
2SO3(g)。研究发现,

SO3的体积分数(SO3%)随温度(T)的变化如上图所示:
下列判断正确的是?
A. 该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
4、计算题 (12分)在容积为5L的密闭容器中,通入5 mol? N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:

 (1)2 min时,容器内n(N2)==?,c(H2)==?。
(1)2 min时,容器内n(N2)==?,c(H2)==?。
(2)2 min内,以N2表示的平均反应速率v(N2)==?。

 (3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:
(3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:
5、填空题 (甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)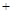 2H2(g)
2H2(g)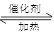 CH3OH(g)
CH3OH(g)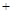 Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
?
(1)判断反应达到平衡状态的依据是(?)
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q?0 (填“>”、“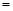 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是(?)
A.加入催化剂? B.充入CO? C.充入H2? D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v ?mol /(L·min),
?mol /(L·min),
CO的转化率为?。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)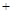 CO2(g)
CO2(g)  2CO(g)?平衡常数K1
2CO(g)?平衡常数K1
C(s)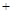 H2O(g)
H2O(g)  CO(g)
CO(g)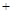 H2(g)?平衡常数K2
H2(g)?平衡常数K2
CO(g)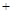 H2O(g)
H2O(g)  H2(g)
H2(g)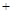 CO2(g)?平衡常数K3
CO2(g)?平衡常数K3
则K1、K2、K3之间的关系是:?。