1、选择题 在容积不变的密闭容器中进行如下反应:N2+3H2 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
A.平衡不发生移动
B.平衡沿着逆反应方向移动
C.正逆反应速率都增大
D.NH3的质量分数增加
2、选择题 下列表格中的各种情况,可以用下面的图象曲线表示的是
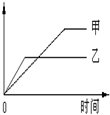
?
| 反应
| 纵坐标
| 甲
| 乙
|
A
| 等质量钾、钠分别与足量水反应
| H 2质量
| ?
钠
| ?
钾
|
B
| 相同质量氨气,在同一容器中
2NH3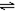 N2+3H2?ΔH >0 N2+3H2?ΔH >0
| 氨气的转化率
| 500℃
| 400℃
|
C
| 在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2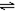 2NH3 2NH3
| 氨气的浓度
| 活性一般的催化剂
| 活性高的催化剂
|
D
| 2molSO2与lmolO2,在相同温度下2SO2(g)+O2(g)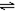 2SO3(g) 2SO3(g)
| SO3物质的量
| 2个大气压
| 10个大气压
|
?
3、选择题 在密闭容器中,一定量混合气体发生下列反应: aM(g)+?bN(g)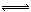 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是(?)
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是(?)
A.反应速率增大
B.平衡向正反应方向移动
C.N的转化率提高
D.W的体积分数降低
4、选择题 可逆反应2HI(g) H2+I2(g)在密闭容器中装入1molHI气体在一定条件下使它分解,已知有35%发生分解,则容器内混合气体的总物质的量是
H2+I2(g)在密闭容器中装入1molHI气体在一定条件下使它分解,已知有35%发生分解,则容器内混合气体的总物质的量是
A.1mol
B.0.5mol
C.1.5mol
D.2mol
5、填空题 (12分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N2(g)与适量H2(g)完全反应,当生成NH3(g)0.1mol时,放出9.22kJ热量,写出反应的热化学方程式:?。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1?K2(填“>”? “="”" 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为?,用氮气表示的反应速率:?。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:?(任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中?(填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中?(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是?。
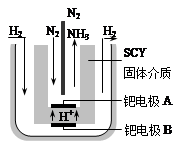
钯电极A是电解池的?极(填“阳”或“阴”),该极上的电极反应式是?。