1、选择题 & 91exam .orgnbsp;下列化学用语正确的是
A.硝基苯的结构简式:
B.Be原子的核外电子排布式:1s22s22p1
C.氯化铵的电子式: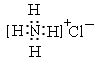
D.CO2分子的结构式:O=C=O
参考答案:D
本题解析:A 错误,苯环上的碳原子应直接和氮原子相连,不是和氧原子相连。
B 错误,Be是4号元素,核外电子排布式:1s22s2
C 错误,氯元素周围也要画出8个黑点,用中括号括起,然后带一个单位负电荷。
D 正确,碳原子和氧原子都形成了8电子稳定结构。
本题难度:简单
2、填空题 (16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:

已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
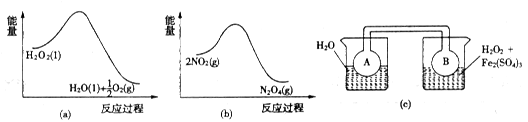
参考答案:(16分) (1)TiO2?xH2O、Fe(2分);(2)1:4 (2分)(3)防止NH4HCO3分解(或减少Fe2+的水解)(2分)
(4)Fe2+ + 2HCO3一="=" FeCO3 ↓+ H2O + CO2 ↑(2分)
(5)乳酸(电离出的H+)与CO32一反应,降低了CO32一的浓度,使上述沉淀溶解平衡正向移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)
(6)2SO42--2e-==S2O82-(2分)
(7)①深(2分);②H2O2分解放热,使平衡2NO2 N2O4向生成NO2方向移动(2分)
N2O4向生成NO2方向移动(2分)
本题解析:(1)在反应废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,向其中加入Fe屑,发生反应:Fe2(SO4)3+Fe= 3FeSO4; Fe+H2SO4= FeSO4+ H2↑; 随着反应的进行,溶液的酸性减弱,TiOSO4发生水解反应: TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4;所以得到的滤渣成分是TiO2?xH2O;(2) ③FeSO4溶液蒸发浓缩,冷却结晶得到绿矾,然后将其在空气中煅烧,发生反应:4FeSO4+O2 2Fe2O3+4SO3,生成铁红和三氧化硫,该反应中氧化剂是O2,还原剂是FeSO4。由于在氧化还原反应中电子转移守恒,所以氧化剂与还原剂的物质的量之比1:4;(3)步骤④是FeSO4溶液中加入NH4HCO3,来制取FeCO3,需控制反应温度低于35℃,是为了防止NH4HCO3分解及减少Fe2+的水解反应的发生;(4)步骤④反应的离子方程式是Fe2+ + 2HCO3一="=" FeCO3 ↓+ H2O + CO2 ↑;(5) FeCO3难溶于水,但是在水中也有一定的溶解度,因此在溶液中存在沉淀溶解平衡:FeCO3(s)
2Fe2O3+4SO3,生成铁红和三氧化硫,该反应中氧化剂是O2,还原剂是FeSO4。由于在氧化还原反应中电子转移守恒,所以氧化剂与还原剂的物质的量之比1:4;(3)步骤④是FeSO4溶液中加入NH4HCO3,来制取FeCO3,需控制反应温度低于35℃,是为了防止NH4HCO3分解及减少Fe2+的水解反应的发生;(4)步骤④反应的离子方程式是Fe2+ + 2HCO3一="=" FeCO3 ↓+ H2O + CO2 ↑;(5) FeCO3难溶于水,但是在水中也有一定的溶解度,因此在溶液中存在沉淀溶解平衡:FeCO3(s)  Fe2+(aq)+CO32-(aq),当向其中加入乳酸时,乳酸电离出的H+与CO32一反应,形成HCO3-,降低了CO32一的浓度,使上述沉淀溶解平衡正向移动,使碳酸亚铁溶解得到乳酸亚铁溶液;(6)在溶液B中含有SO42一,常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生氧化反应,该电极的电极反应可表示为2SO42--2e-==S2O82-;(7)根据图a可知H2O2的负极反应是放热反应,反应2NO2
Fe2+(aq)+CO32-(aq),当向其中加入乳酸时,乳酸电离出的H+与CO32一反应,形成HCO3-,降低了CO32一的浓度,使上述沉淀溶解平衡正向移动,使碳酸亚铁溶解得到乳酸亚铁溶液;(6)在溶液B中含有SO42一,常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生氧化反应,该电极的电极反应可表示为2SO42--2e-==S2O82-;(7)根据图a可知H2O2的负极反应是放热反应,反应2NO2 N2O4的正反应是放热反应。在装置c的左边烧内放有水,在右边的烧杯内放有H2O2和Fe2(SO4)3的混合溶液,因为Fe3+对H2O2的分解具有催化作用,所以H2O2会不断分解,放出热量没事右边的烧杯内的水的温度升高。根据平衡移动原理:升高温度,平衡向吸热的逆反应方向移动,NO2浓度增大,所以连通器内的气体颜色加深。
N2O4的正反应是放热反应。在装置c的左边烧内放有水,在右边的烧杯内放有H2O2和Fe2(SO4)3的混合溶液,因为Fe3+对H2O2的分解具有催化作用,所以H2O2会不断分解,放出热量没事右边的烧杯内的水的温度升高。根据平衡移动原理:升高温度,平衡向吸热的逆反应方向移动,NO2浓度增大,所以连通器内的气体颜色加深。
考点:考查生产钛白粉产生的废液的综合利用的知识。主要包括物质的分离、氧化还原反应中物质的关系、盐的水解、沉淀溶解平衡、原电池反应原理、反应热的综合利用及温度对可逆反应的平衡移动的影响。
本题难度:困难
3、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是(? )
A.F原子结构示意图
B.甲烷的结构简式CH4
C.新戊烷的分子式 C5H8
D.甲基的电子式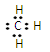
参考答案:B
本题解析:F原子的最外层电子数是7个,A不正确。新戊烷的分子式为C5H12,C不正确。甲基是9电子微粒,电子式为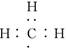 ,D不正确。所以正确的答案是B。
,D不正确。所以正确的答案是B。
本题难度:一般
4、选择题 下列有关说法中,正确的是
A.分馏、干馏都是物理变化
B.127I和131I互为同素异形体
C.硫酸铜、二氧化硫都是电解质
D.盐酸、漂白粉都是混合物
参考答案:D
本题解析:略
本题难度:简单
5、选择题 在2Cu(NO3)2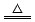 2CuO+4NO2↑+O2↑反应中,被氧化的元素是
2CuO+4NO2↑+O2↑反应中,被氧化的元素是
A.Cu
B.N
C.O
D.Cu和O
参考答案:C
本题解析:略
本题难度:一般