1、填空题 写出下列物质的电子式:
(1)MgCl2??(2) CO2??(3)NaOH??(4) H2O2?
参考答案:(1)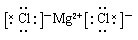 (2)
(2)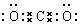 (3)
(3)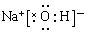 (4)
(4)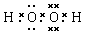
本题解析:考查常见物质电子式的书写。书写电子式首先要判断化学键类型,然后再书写,氯化镁是含有离子键的离子化合物,CO2是含有极性键的共价化合物,氢氧化钠是含有离子键和极性键的离子化合物,双氧水是含有极性键和非极性键的共价化合物。
本题难度:简单
2、选择题 下列化学变化过程中不涉及氧化还原反应的是?(?)
A.氯碱工业
B.水玻璃制硅酸
C.工业制硝酸
D.海水中提炼镁
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列化学用语不正确的是
A.二氧化碳的电子式是:
B.铝离子的结构示意图是: 
C.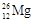 的中子数与质子数之差是2
的中子数与质子数之差是2
D.Na2O2中的阳离子数与阴离子数之比为1:1
参考答案:D
本题解析:D、不正确,Na2O2中O22―是原子团,Na2O2中的阳离子数与阴离子数之比为2:1,其余正确,选D。
考点?:化学用语
本题难度:一般
4、简答题 将5.0g碳酸钙放入一定量稀盐酸中恰好完全反应,得到40mL密度为1.32g/mL的溶液.试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量浓度.
(3)所用稀盐酸的质量分数.
参考答案:(1)根据碳原子守恒得CaCO3----CO2,设二氧化碳的体积为x,
CaCO3----CO2
100g 22.4L
5.0g x
100g:22.4L=5.0g:x
x=5.0g×22.4L100g=1.12L,
答:生成标准状况下的二氧化碳气体1.12L;
(2)根据钙原子守恒得CaCO3----CaCl2,氯化钙的物质的量=5.0g100g1×1=0.05mol,氯化钙的物质的量浓度=0.05mol0.04L=1.25mol/L,
答:所得溶液中氯化钙的物质的量浓度为1.25mol/L;
(3)根据CaCO3----2HCl知,氯化氢的质量=5.0g100g/mol1×2×36.5g/mol=3.65g,二氧化碳的质量=1.12L22.4Lmol×44g/mol=2.2g,根据质量守恒定律得盐酸的质量=40mL×1.32g/mL+2.2g-5.0g=50g,则盐酸的质量分数=3.65g50g×100%=7.3%,
答:所用稀盐酸的质量分数7.3%.
本题解析:
本题难度:一般
5、选择题 下列有关化学用语表示正确的是(?)
A.乙炔的电子式: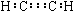
B.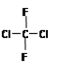 和
和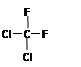 是同一物质
是同一物质
C.对甲基苯甲醇的结构简式:
D.乙醇分子的比例模型: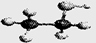
参考答案:B
本题解析:乙炔分子中,每个碳原子提供3个电子,A错;C为对甲基苯酚,命名错;D为球棍模型。
本题难度:一般