1、选择题 下列设备工作时,将化学能转化为电能的是(? )

参考答案:B
本题解析:A、硅太阳能电池是将太阳能直接转化为电能,错误;B、锂离子电池将化学能直接转化为电能,错误;C、太阳能集热器是将太阳能转变为热能,错误;D、燃料燃烧将化学能直接转化为热能,正确。
本题难度:简单
2、填空题 (共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为?。
②又已知H2O(l)=H2O(g)? ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是?kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是?。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)?△H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)?△H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)?△H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________?
参考答案:(1)①N2H4(l)+2H2O2(l) = N2(g) +4H2O(g)?△H=-644.25 KJ/mol?(3分)
② 410.125?(3分)?
③产物不会造成环境污染。(3分)
(2)CO(g)+FeO(s) ="=" Fe(s)+CO2(g)?△H=―218.0kJ/mol?(3分)
本题解析:(1)①根据题意知,肼和双氧水反应生成氮气和水,化学方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量,则1mol液态肼反应放出的热量为644.25kJ,热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=—644.25kJ/mol;②根据①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=—644.25kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律:①—②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=—820.25KJ/mol,16g液态肼物质的量为0.5mol,与液态双氧水反应生成液态水时放出的热量为410.125KJ;③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,不会造成环境污染。
(2)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=—24.8kJ/mol?①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=—47.2kJ/mol?②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol?③
根据盖斯定律:①×1/2—②×1/6—③×1/3得?CO(g)+FeO(s)=Fe(s)+CO2(g)△H=—218.0kJ/mol?。
本题难度:一般
3、选择题 热化学方程式C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
为( )
A.碳与水反应吸收131.3 kJ的热量
B.1 mol碳和1 mol水反应吸收131.3 kJ的热量
C.1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量
D.固态碳和气态水各1 mol反应,放出131.3 kJ的热量
参考答案:C
本题解析:热化学方程式中的系数代表物质的量,且要指明物质的聚集状态,C项正确。
本题难度:一般
4、填空题 (4分)指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭?,
(2)给手机的电池充电?,
(3)用畜电池点亮灯泡?,
(4)电解水得到O2和H2?。
参考答案:化学能转化为电能;电能转化为化学能;电能转化为光能和热能;电能转化为化学能。
本题解析:考查常见的能量变化。燃烧是化学能转化为电能;电池充电是电能转化为化学能;蓄电池点亮灯泡是电能转化为光能和热能;电解水是电能转化为化学能。
本题难度:简单
5、填空题 如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5 mL稀盐酸,试完成下列问题。
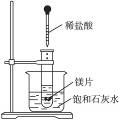
(1)实验中观察到的现象是__________________。
(2)产生上述现象的原因是__________________。
(3)写出有关反应的离子方程式__________________。
(4)由实验推知,MgCl2溶液和H2的总能量__________________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)镁片上有大量气泡产生,镁片逐渐溶解;烧杯中有晶体析出?(2)镁与盐酸反应放出H2,是放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体?(3)Mg+2H+====Mg2++H2↑? Ca2++2OH-====Ca(OH)2↓? (4)小于
本题解析:(1)镁与盐酸反应产生氢气,此反应为放热反应,使烧杯内温度升高,Ca(OH)2的溶解度随温度升高而减小,故有晶体Ca(OH)2析出。(4)由镁和盐酸反应生成MgCl2和H2,是放热反应,根据能量变化规律知MgCl2和H2的总能量加上放出的能量应等于Mg和盐酸的总能量,故MgCl2和H2总能量小于Mg和盐酸的总能量。
本题难度:简单