1、选择题 在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是? ( )。
A.2H2(g)+O2(g)=2H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(g) ΔH2
B.S(g)+O2(g)=2SO2(g) ΔH1;S(s)+O2(g)=2SO2(g) ΔH2
C.C(s)+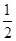 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1;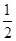 H2(g)+
H2(g)+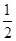 Cl2(g)=HCl(g) ΔH2
Cl2(g)=HCl(g) ΔH2
参考答案:C
本题解析:A项中生成液态水比生成气态水放出的热量多,故ΔH1<ΔH2;B项中气态硫参加反应时比固态硫放出的热量多,则ΔH1<ΔH2;C项中生成CO时比生成CO2放出的热量少,ΔH1>ΔH2;D项中ΔH1=2ΔH2<0,即ΔH1<ΔH2。
本题难度:简单
2、选择题 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应
SO2(g)+NO2 (g)  ?SO3(g)+NO(g)
?SO3(g)+NO(g)
达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的不正确结论是
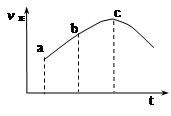
A.反应物的总能量高于生成物的总能量
B.反应物浓度:a点大于b点
C.反应在c点达到平衡状态
D.SO2的转化率:a点小于b点
参考答案:C
本题解析:A.因为随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,正反应是放热反应,故反应物的总能量高于生成物的总能量,正确;B. 因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,正确;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,原说法不正确;D.因为反应一直在向正向进行,故SO2的转化率:a点小于b点,正确。
本题难度:一般
3、选择题 下列说法不正确的是
A.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热
B.当化学反应A→B △H <O,则稳定性B>A
C.△H近似等于生成物的总键能减去反应物的总键能
D.吸热反应在常温、常压下也可能发生
参考答案:C
本题解析:略
本题难度:简单
4、选择题 已知反应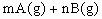

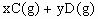 ,A的转化率
,A的转化率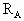 与p、T的关系如图,根据图示可以得出的正确结论是 ?
与p、T的关系如图,根据图示可以得出的正确结论是 ?
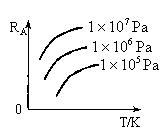
A.正反应放热
B.正反应吸热
C.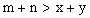
D.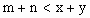
参考答案:BC
本题解析:略
本题难度:简单
5、选择题 已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.
下列结论正确的是( )
A.碳的燃烧热小于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ
参考答案:A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A错误;
B、反应热包含符号,①的反应热为-221 kJ?mol-1,故B错误;
C、中和热是稀溶液中强酸和强碱反应生成1mol水放出的热量,△H=-57.3 kJ/mol,所以稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol,故C正确;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D正确;
故选:CD.
本题解析:
本题难度:一般