1、选择题 将铜和镁的合金完全溶于浓HNO3溶液中,若反应中HNO3被还原产生4.48L(标准状况,下同)NO2气体和0.336 L N2O4气体,向反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为8.51g,则合金的质量为(?)
A.2.7g
B.4.6g
C.8.2g
D.无法计算
参考答案:B
本题解析:略
本题难度:一般
2、实验题 (12分)镁是一种很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中利用镁制取硅的反应为2Mg+SiO2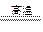 2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si
2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si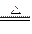 Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
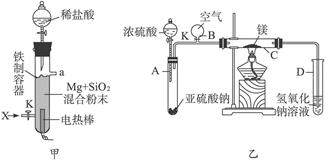
(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的________________。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物。其理由是_____________________________;当反应引发后,切断电源,反应能继续进行,其原因是_____________________________。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知____________________在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为______________________。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______________________________。
Ⅲ.C中全部反应产物有___________、___________、___________(填化学式)。
参考答案:(1)Ⅰ.③? Ⅱ.防止加热条件下H2与空气混合爆炸,Mg与SiO2的反应是放热反应? Ⅲ.SiH4? (2)Ⅰ.在加热条件下,Mg能与玻璃中的SiO2反应? Ⅱ.防止C管降温时因气体压强减小,而引起D中溶液倒流? Ⅲ.MgO? S? MgS
本题解析:(1)镁加热时与N2、CO2都会反应,故选H2作为保护气,加热条件下H2与空气混合易发生爆炸,必须先通入H2排净空气后再加热,Mg与SiO2的反应是放热反应,引发后不需再加热,反应也能继续进行。Mg2Si遇盐酸迅速反应生成SiH4(硅烷),在空气中能自燃。(2)根据题给信息:玻璃中含有一定量的二氧化硅,可发生:2Mg+SiO2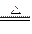 2MgO+Si,故C中的Mg应放在不锈钢垫片上而不能直接接触管壁。乙中的橡胶气胆设置巧妙,可平衡C管气体压强。淡黄色物质是硫,有臭鸡蛋气味的气体是H2S,据此推出C中产物,H2S 应来源于MgS。
2MgO+Si,故C中的Mg应放在不锈钢垫片上而不能直接接触管壁。乙中的橡胶气胆设置巧妙,可平衡C管气体压强。淡黄色物质是硫,有臭鸡蛋气味的气体是H2S,据此推出C中产物,H2S 应来源于MgS。
本题难度:简单
3、选择题 将烧碱溶液和盐酸依次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是
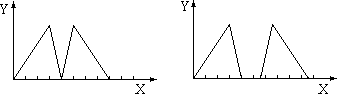
A.三溴化铝溶液
B.偏铝酸钠溶液
C.明矾溶液
D.硝酸铝溶液
参考答案:B
本题解析:偏铝酸钠溶液滴入氢氧化钠,溶液无现象,然后再滴加盐酸,则首先中和溶液中的氢氧化钠,若继续滴加盐酸,则氢氧化铝沉淀,方程式为NaAlO2+H2O+HCl=Al(OH)3↓。当沉淀不再发生变化时,再加入盐酸会溶解氢氧化铝,方程式为Al(OH)3+3HCl=AlCl3+3H2O,所以选项B不符合。答案选B。
本题难度:简单
4、选择题 2005年1月,美国科学家在《Science》上发表论文,宣布发现Al的超原子结构 ,如Al13、Al14。Al13、Al14的一些性质像其它的主族元素的化学性质,得到或失去电子后生成40个价电子的最稳定状态。下列说法中不正确的是(?)
A.Al13与卤族单质的性质相似
B.Al14与第IIA族元素的性质相似
C.Al13和Al14互为同位素
D.Al14中的Al原子间以离子键相结合
参考答案:D
本题解析:略
本题难度:简单
5、填空题 由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
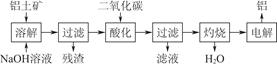
(1)电解生成的铝在熔融液的?(填“上层”或“下层”),电解时不断消耗的电极是?(填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式?
?。
(3)电解制备铝时,需加入冰晶石(Na3AlF6),其作用是?,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式?。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是?(填化学式),阳极的电极反应式为?。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
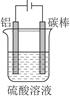
①控制一定条件进行电解(见图),此时铝表面可形成耐酸的致密氧化膜,其电极反应式为?;
②钢材镀铝后,能防止钢材腐蚀,其原因是?。
参考答案:(1)下层 阳极
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)助熔剂(或降低熔化温度)? 2Al(OH)3+12HF+3Na2CO3 2Na3AlF6+3CO2+9H2O
2Na3AlF6+3CO2+9H2O
(4)Al Al-3e-=Al3+
(5)①2Al-6e-+3H2O=Al2O3+6H+
②致密的氧化铝膜起着保护内部金属的作用,若镀层破损后,与电解质溶液接触时形成原电池,铝作负极防止钢材被腐蚀
本题解析:(1)电解熔融的氧化铝冶炼铝,阳极生成O2,与石墨电极反应生成CO。(3)氧化铝的熔点很高,是常用的耐高温材料,故冶炼时加入冰晶石降低其熔点。(4)迁移电解法精炼铜的原理,电解时铝在阴极析出,故阴极材料为纯铝。(5)根据题中信息,铝表面生成的应为Al2O3,故阳极电极反应为铝失去电子,生成的Al3+与H2O作用形成Al2O3。
本题难度:一般