|
|
|
高中化学知识点总结《化学反应速率》高频考点强化练习(2019年最新版)(一)
2019-06-25 23:25:27
【 大 中 小】
|
1、选择题 决定化学反应速率的主要因素是
[? ]
A.参加反应的物质本身的性质
B.催化剂
C.温度、压强以及反应物的接触面
D.反应物的浓度
2、选择题 在不同条件下分别测得反应2SO2+O2 2SO3的化学反应速率,其中表示该反应进行得最快的是 2SO3的化学反应速率,其中表示该反应进行得最快的是
A.v (SO2)=4mol/(L·min)
B.v (SO2)=0.1mol/(L·s)
C.v (O2)=3mol/(L·min)
D.v (O2)=0.1mol/(L·s)
|
3、选择题 在一定条件下,将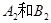 两种气体通入密闭容器中,反应按 两种气体通入密闭容器中,反应按  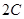 进行,2秒钟后反应速率如下: 进行,2秒钟后反应速率如下: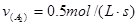 , ,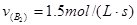 , , ,则x、y的值分别为( ) ,则x、y的值分别为( )
A.3和2
B.1和3
C.3和1
D.4和5
|
4、填空题 (11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g)?CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g)?CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) ?CH3OH (g)+H2(g)的△H= kJ·mol-1。
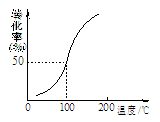
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。
(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
5、选择题 在2A+B===3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是(?)
A.vA=0.5mol·L-1·min-1
B.vB=0.3mol·L-1·min-
C.vC=0.8mol·L-1·min-1
D.vD=1mol·L-1·min-1

 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。 减小,
减小,