1、选择题 下列关于金属铝的叙述中,说法不正确的是( )
A.Al是地壳中含量最多的元素
B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.Al箔在空气中受热可以熔化,但是不能剧烈燃烧
D.Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落
参考答案:A、地壳中含量最多的几种元素是氧、硅、铝、铁等,故含量最多的金属是铝,含量 91ExaM.org最多的元素是氧元素,故A错误;
B、Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性,故B正确;
C、铝箔在空气中受热可以溶化,铝与氧气反应生成氧化铝为致密的氧化物,阻止反应的进一步发生,则不会剧烈燃烧,故C正确;
D、Al箔在空气中受热可以熔化,由于氧化膜的存在,包在铝的外面,所以熔化的Al并不滴落,故D正确;
本题解析:
本题难度:一般
2、选择题 常温下,将等物质的量的铜片、铁片、铝片、银片分别置于4个小烧杯中,然后各加入足量的浓硝酸,放出NO2气体的体积最多的是
[? ]
A.铜片
B.铁片
C.银片
D.铝片
参考答案:A
本题解析:
本题难度:简单
3、计算题 (9分)?现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,
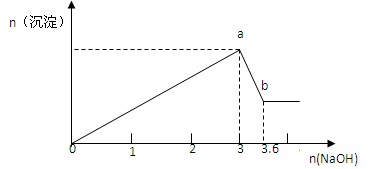
请计算出(1)a处沉淀的总物质的量?mol;
(2)c(FeCl3)=?mol/L ;?(3)c(AlCl3)=?mol/L
参考答案:(1)1?(2) 4?(3) 6
本题解析:氯化铁、氯化铝和氢氧化钠反应分别生成氢氧化铁和氢氧化铝沉淀。但氢氧化铝是两性氢氧化物,能溶于氢氧化钠中。所以根据图像可知a点是氢氧化铁和氢氧化铝沉淀,b点是氢氧化铁沉淀。溶解氢氧化铝消耗氢氧化钠是0.6mol。所以根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知氢氧化铝是0.6mol,根据原子守恒可知氯化铝也是0.6mol,浓度是0.6mol÷0.1L=6.0mol/L。根据反应FeCl3+3NaOH=Fe(OH)3↓+3NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl可知,生成0.6mol氢氧化铝消耗氢氧化钠是1.8mol,所以和氯化铁反应的氢氧化钠是3mol-1.8mol=1.2mol,因此氯化铁是0.4mol,浓度是4.0mol/L。氢氧化铁和氢氧化铝一共是0.6mol+0.4mol=1.0mol。
本题难度:一般
4、简答题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+.回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为______(用化学式表示).
(2)写出锌和氢氧化钠溶液反应的化学方程式______.
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______.
①硫酸铝和氢氧化钠?②硫酸铝和氨水③硫酸锌和氢氧化钠④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式______.试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因______.
参考答案:(1)属铝和氢氧化钠反应生成偏铝酸钠和氢气,溶液中铝元素的存在形式为Na[Al(0H)4],故答案为:Na[Al(OH)4];
(2)根据题干信息得锌和氢氧化钠溶液反应的化学方程式为:Zn+2NaOH+2H2O=Na2[Zn(0H)4]+H2↑,故答案为:Zn+2NaOH+2H2O=Na2[Zn(0H)4]+H2↑;
(3)①硫酸铝中加氢氧化钠,先出现沉淀,然后沉淀消失,然后又出沉淀,向氢氧化钠中加硫酸铝没有现象,故用相互滴加的实验方法可以鉴别;
②硫酸铝和氨水不管是谁往谁中相互滴加是现象均是出现白色沉淀,用相互滴加的实验方法不可以鉴别;
③往硫酸锌中加氢氧化钠时,会出现白色沉淀,向氢氧化钠中加硫酸锌时,无现象,故用相互滴加的实验方法可以鉴别;
④往硫酸锌中加氨水时,会出现白色沉淀,向氨水中加硫酸锌时,无现象,故用相互滴加的实验方法可以鉴别;
故答案为:①③④;
(4)可溶性铝盐与氨水反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌,因为可溶性锌盐与氨水反应产生
的氢氧化锌可溶于过量的氨水中,生成Zn(NH3)42+,氨水的量不易控制.故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的氢氧化锌可溶于过量
的氨水中,生成Zn(NH3)42+,氨水的量不易控制.
本题解析:
本题难度:一般
5、选择题 等量镁铝合金分别与下列4种过量的溶液充分反应,放出氢气最多的是
[? ]
A.2mol·L-1H2SO4溶液
B.18mol·L-1H2SO4溶液
C.6mol·L-1KOH溶液
D.3mol·L-1HNO3溶液
参考答案:A
本题解析:
本题难度:一般