1、选择题 现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是(? )
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
参考答案:C
本题解析:溶液①为单一的醋酸溶液,所以溶液中有CH3COO-、H+、OH- 3种离子,因此A选项不满足电荷守恒,A错误;溶液①、②等体积混合,则酸碱恰好完全中和生成醋酸钠,但是由于等体积混合,体积增大,得到的c(CH3COO- )< 0.1mol·L-1 ,但是由于物料守恒,所得溶液有c(CH3COO-)+c(CH3COOH) = c(Na+),所以B错误,C正确;溶液①、③等体积混合,溶液呈酸性,因此c(H+)> c(OH-),而c(Na+)< c(CH3COO-),所以D错误,故选C。
本题难度:一般
2、选择题 已知 25℃时有关弱酸的电离平衡常数:
弱酸化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数(25℃)
| 1.8×10-5
| 4.9×10-10
| Ka1=4.3×10-7
Ka2=5.6×10-11
|
则下列说法正确的是(?)
A.等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO?3)>pH( CH3COONa)
B.浓度均为0.2mol/LNaHCO3和 Na2CO3溶液中,存在的粒子种类不相同
C.0.4 mol·L-1HCN 溶液与 0.2 mol·L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+)
D.25℃时,pH=4且浓度均为0.1 mol·L-1的 CH3COOH、CH3COONa混合溶液中:
c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH)
参考答案:C
本题解析:由所给电离平衡常数知,酸性:CH3COOH>H2CO3>HCN>HCO3—
A项:越弱越水解,可知等物质的量浓度的各溶液 pH 关系为:pH(Na2CO?3)>pH ( NaCN)>pH( CH3COONa)
B项:任何浓度下NaHCO3和 Na2CO3溶液的粒子种类必相同
C项:反应后相当于等浓度的NaCN与HCN的混合溶液,由于NaCN水解程度大于HCN的电离,故溶液为碱性,答案正确。
D项:c(Na+)="0.1" mol·L-1,由物料守恒知:c(CH3COO-)+c(CH3COOH)="0.2" mol·L-1;c(H+)=10—4 mol·L-1,很明确此项不正确
本题难度:一般
3、选择题 在允许加热的条件下,只用一种试剂就可鉴别NH4Cl、(NH4)2SO4、NaCl、Al2(SO4)3和Fe2(SO4)3溶液,该试剂可能是
A.Ba(OH)2溶液
B.AgNO3溶液
C.NaOH溶液
D.BaCl2溶液
参考答案:A
本题解析:取样,分别加入Ba(OH)2溶液,加热,只有刺激性气味的气体生成的是NH4Cl;既有刺激性气体,又有白色沉淀生成的是(NH4)2SO4;没现象的是NaCl;只有白色沉淀,但沉淀又部分溶解的是Al2(SO4)3;有白色沉淀和红褐色沉淀生成的是Fe2(SO4)3;故此试剂是Ba(OH)2溶液。
本题难度:一般
4、选择题 等体积的下列溶液中,阳离子总数最多的是()
A.0.1mol·L-1的FeCl3溶液
B.0.1mol·L-1的AlCl3溶液
C.0.05mol·L-1的Na2S溶液
D.0.05mol·L-1的Al2(SO4)3溶液
参考答案:A
本题解析:Fe3+、Al3+水解,每1molFe3+、Al3+水解可产生3molH+,Fe3+的水解能力比Al3+强,所以0.1mol·L-1的FeCl3中阳离子最多。
本题难度:简单
5、选择题 有关①100ml 0.1 mol/L 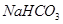 、②100ml 0.1 mol/L
、②100ml 0.1 mol/L 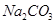 两溶液叙述不正确的是
两溶液叙述不正确的是
A.溶液中水电离出的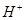 个数:②>①
个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: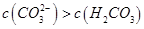
D.②溶液中: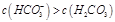
参考答案:C
本题解析:
选项A:因HCO3-的水解程度大于其电离程度,所以NaHCO3溶液显碱性;由于CO32-水解使得
Na2CO3溶液也显碱性。根据越弱越水解原理可知,HCO3-的水解程度小于CO32-,弱离
子水解程度越大,对水的电离程度,所以相同浓度的NaHCO3和Na2CO3溶液中,水电
离出的H+个数:②>①,所以A正确
选项B:HCO3-水解生成H2CO3和OH-,即消耗一个HCO3-的同时又生成一个OH-,水解的过程?
中阴离子数不变;
但CO32-的第一级水解生成HCO3-和OH-,即消耗一个CO32-的同时却生成了两个阴离
子,水解的过程中,阴离子总数在增加;由于起始时CO32-和HCO3-的浓度相同,所以
溶液中阴离子的物质的量浓度之和:②>①,所以B正确
选项C:因HCO3-的水解程度大于其电离程度,所以①溶液中:c(H2CO3)>c(CO32-)
所以C错
选项D:CO32-的第一级水解生成HCO3-,第二级水解生成H2CO3,且以第一级水解为主,所以②
溶液中:c(HCO3-)>c(H2CO3),所以D正确
本题难度:简单