1、选择题 下列说法正确的是
A.0.1 mol/L氨水与0.1 mol/L盐酸等体积混合,所得溶液中c(H+)=c(OH-)
B.100 ℃时,纯水中c(H +)=1×10-6 mol·L-1,此时纯水显酸性
C.25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则a>b
D.25℃时,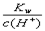 =0.1 mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1 mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存
参考答案:D
本题解析:A. 0.1 mol/L氨水与0.1 mol/L盐酸等体积混合,酸碱恰好完全反应,恰好生成氯化铵,为强酸弱碱盐,溶液显酸性;
B.判断溶液酸碱性最根本的衡量标准为C(H+)=C(OH-), 100 ℃时,纯水中C(H+)=C(OH-)=1×10-6 mol·L-1呈中性;
C. 将pH=a的醋酸溶液稀释,溶液酸性减弱,溶液的pH变大,所以b>a。
本题难度:一般
2、选择题 下列关于电解质溶液的正确判断是
[? ]
A.在pH =12的溶液中,K+、Cl-、Al3+、Na+可以共存
B.在pH=0的溶液中,Na+、NO3-、CO32-、K+可以共存
C.由0.1mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH-
D.由0.1mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O HA+OH-
HA+OH-
参考答案:D
本题解析:
本题难度:一般
3、选择题 体积相同,浓度均为0.1 mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n?的关系为
A.4m=n
B.m=n
C.m<n
D.m>n
参考答案:D
本题解析:略
本题难度:一般
4、填空题 下列说法是否正确?为什么?
(1)NH3在碱性溶液中比在纯水的溶解度大。
(2)氯化钠和醋酸铵的pH都接近于7,因此它们都没有发生水解。
参考答案:(1)不正确。NH3溶于水,存在溶解平衡、化学平衡和电离平衡:
NH3 (g) NH3 (aq);NH3 + H2O
NH3 (aq);NH3 + H2O NH3·H2O
NH3·H2O NH4+ + OH-
NH4+ + OH-
碱性溶液中c (OH-)较大,会促使上述平衡逆向移动,使得NH3的溶解度下降。
(2)不正确。氯化钠pH接近于7,是因为Na+、Cl-不影响水的电离;没有发生水解。而醋酸铵的pH接近于7,是因为CH3COO-、NH4+都发生了水解,只是水解程度几乎相同。
本题解析:(1)不正确,因为NH3溶于水,存在溶解平衡、化学平衡和电离平衡:
NH3 (g) NH3 (aq);NH3 + H2O
NH3 (aq);NH3 + H2O NH3·H2O
NH3·H2O NH4+ + OH-
NH4+ + OH-
碱性溶液中c (OH-)较大,会促使上述平衡逆向移动,使得NH3的溶解度下降。
(2)不正确,氯化钠pH接近于7,是因为Na+、Cl-不影响水的电离;没有发生水解。而醋酸铵的pH接近于7,是因为CH3COO-、NH4+都发生了水解,但二者的水解程度几乎相同,所以溶液显中性。
本题难度:一般
5、选择题 下列盐溶液显酸性的是( )
A.醋酸钠
B.硫酸钾
C.氯化铵
D.碳酸钠
参考答案:A、醋酸钠是强碱弱酸盐水解显碱性,故A错误;
B、硫酸钾是强酸强碱盐显中性,故B错误;
C、氯化铵强酸弱碱盐水解显酸性,故C正确;
D、碳酸钠强碱弱酸盐水解显碱性,故D错误;
故选C.
本题解析:
本题难度:简单