1、填空题 (2分).写出下列物质的电离方程式
(1)H2CO3
(2)KNO3
参考答案:(1)H2CO3 . 2H++HCO3- (2)KNO3 =K++NO3-
. 2H++HCO3- (2)KNO3 =K++NO3-
本题解析: (1)碳酸是弱电解质,所以能部分电离出氢离子和碳酸氢根离子,故写成: H2CO3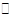 2H++HCO3
2H++HCO3
本题难度:一般
2、选择题 室温下,将1.00mol ? L-1盐酸滴人20. OO mL?1.OOmol ? L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如下图所示。
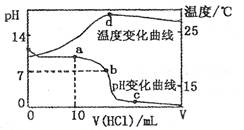
下列有关说法中不正确的是
A.a点溶液中离子浓度大小的关系: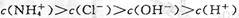
B.b点溶液中离子浓度大小的关系: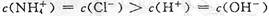
C.c点溶液中离子浓度大小的关系: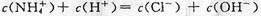
D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3? H2O电离吸热
参考答案:D
本题解析:本题考查溶液中的离子平衡、电解质及中和滴定有关知识。a点溶液中,氨水未完全中和,氨水继续电离,故有 ,A正确;b点溶液显中性有
,A正确;b点溶液显中性有 ,根据电荷守恒有
,根据电荷守恒有 ,且有
,且有 ,B正确;c点溶液中各离子存在电荷守恒,即
,B正确;c点溶液中各离子存在电荷守恒,即 ,C正确;d点时溶液温度达到最高,之后温度略有下降,原因是中和反应已经结束,盐酸温度低,混合后温度降低,D不正确。
,C正确;d点时溶液温度达到最高,之后温度略有下降,原因是中和反应已经结束,盐酸温度低,混合后温度降低,D不正确。
本题难度:一般
3、填空题 (10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________ ______ 。
②几种离子开始沉淀时的pH如下表:
离子
| Fe2+
| Cu2+
| Mg2+
|
pH
| 7.6
| 5.2
| 10.4
|
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,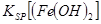 _________
_________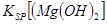 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
参考答案:1)CO32- (2分) C (2分)
(2)①
② Cu2+ (2分) < (2分)
本题解析:(1)五种钠盐都属于强碱弱酸盐,越弱越水解,且水解后的溶液碱性越强,水解程度越大,故Na2CO3水解程度最大,即CO32-结合H+能力最强。由表知道,CH3COOH最弱,故越弱越电离,稀释后,最弱的pH变化最大。
(2)①0.3mol的NaOH溶液吸收标准状况下4.48LCO2时,CO2过量,故生成物为NaHCO3,在溶液中,存在着HCO3-的电离和水解反应,且水解大于电离
考点:弱电解质的电离和水解。
点评:此题考核了弱电解质的电离和水解,要记得弱酸根或弱碱根是越弱越水解,弱酸盐和弱碱盐是越弱越电离。
本题难度:简单
4、选择题 下列各式中正确表示电解质电离的是( )
A.H3PO4 3H++PO43-
3H++PO43-
B.HCO3-+H2O  H3O++CO32-
H3O++CO32-
C.CH3COONH4 CH3COO-+NH4+
CH3COO-+NH4+
D.NaHS==Na++H++S2-
参考答案:B
本题解析:弱酸分步电离,H3PO4 H++H2PO4-,H2PO4-
H++H2PO4-,H2PO4- 2H++HPO42-,HPO42-
2H++HPO42-,HPO42- H++PO43- ,A错;CH3COONH4是强电解质用等号连接,C错;HS-不拆D错。
H++PO43- ,A错;CH3COONH4是强电解质用等号连接,C错;HS-不拆D错。
本题难度:简单
5、选择题 中和c(H+)相同、体积相同的H2SO4、HCl和CH3COOH溶液,耗用同一浓度的NaOH溶液,体积分别为
V1、V2和V3,则V1、V2和V3的关系正确的是
[? ]
A.V1>V2=V3
B.V3>V2=V1
C.V1>V2>V3
D.V1=V2=V3
参考答案:B
本题解析:
本题难度:一般