1、选择题 下列各组物质中都属于弱电解质的一组物质是(? )?
A. NH3、SO2、H2O、HI B.HF、H2O、NH3?H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S?D.NaHSO3、H2O、CO2、H2CO3
参考答案:B
本题解析:NH3、SO2都是非电解质,它们的水溶液能导电的原因是因为NH3?H2O和H2SO3的电离引起的,而HI是强电解质,A错误;B组中的各化合物在水溶液中都能部分电离,B正确;BaSO4溶于水的那部分是全部电离的,是强电解质,而Cl2是单质,C错误;NaHSO3是盐,溶于水时全部电离,是强电解质,而CO2是非电解质,D错误。
本题难度:简单
2、选择题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表:
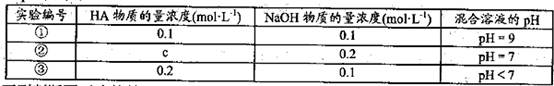
下列判断不正确的是
A.HA的电离方程式为: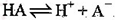
B.不考虑其他组的实验结果,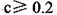
C.③组实验中,混合溶液中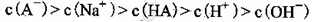
D.①组实验中,混合溶液中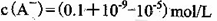
参考答案:D
本题解析:A、由①一元酸与一元强碱等体积混合,溶液呈碱性,说明该酸为弱酸,所以HA的电离方程式正确;B、不考虑其他组的实验结果,与氢氧化钠等体积混合溶液呈中性时,说明若酸为强酸则c=0.2,若酸为 弱酸则酸过量,c>0.2,所以c≥0.2,正确;C、③组中,溶液呈酸性,所得溶液为NaA和HA的混合液,酸的电离大于酸根离子的水解程度,所以离子浓度的大小关系是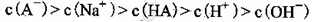 ,正确;D、根据物料守恒和质子守恒得c(A-)=(0.05+10-9-10-5)mol/L,错误,答案选D。
,正确;D、根据物料守恒和质子守恒得c(A-)=(0.05+10-9-10-5)mol/L,错误,答案选D。
本题难度:一般
3、选择题 已知室温时,0.01mo1?L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.加水稀释,溶液的pH增大
B.该溶液由水电离出的c(H+)为10-9mo1?L-1
C.该溶液的pH=4
D.HA与NaOH等物质的量反应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
参考答案:A、加水稀释,促进弱酸的电离,但氢离子的浓度变小,则溶液的pH增大,故A正确;
B、酸电离生成的氢离子为0.01mo1/L×0.1%=10-5mo1?L-1,室温下Kw=1×10-14,则由水电离出的c(H+)为10-1410-5=10-9mo1?L-1,故B正确;
C、酸电离生成的氢离子为0.01mo1/L×0.1%=10-5mo1?L-1,则pH=-lgc(H+)=5,故C错误;
D、HA为弱酸,则HA与NaOH等物质的量反应生成NaA,A-水解,则c(Na+)>c(A-),水解显碱性,则c(OH-)>c(H+),又水解的程度很弱,则c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选C.
本题解析:
本题难度:一般
4、填空题 (10分)
Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2+ + 2OH-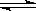 ?M(OH)2
?M(OH)2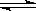 ?2H+ + MO22-
?2H+ + MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25Co时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)?,C(H+)?,水的电离度?,Kw?
(2)(4分)25Co时,向A的稀溶液中加入少量的烧碱固体。
则水的电离度?,溶液的pH?
Ⅱ、.(2分)室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为??10 (填大于、等于或小于)
参考答案:(10分)
Ⅰ、(1)
①C(OH-)变大?,C(H+)变大变,水的电离度变小?,Kw?不变?
(2)
则水的电离度?不变?,溶液的pH不变?
Ⅱ、.(2分)C(OH-)之比为?等于??10 (填大于、等于或小于)
本题解析:略
本题难度:一般
5、选择题 常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:
NaA+ CO2+ H2O==HA+NaHCO3
2NaB+CO2+H2O==2HB+ Na2CO3,
则等物质的量浓度的HA和HB溶液电离出H+的能力大小关系是
[? ]
A.HA较强
B.HB较强
C.两者一样
D.无法比较
参考答案:A
本题解析:
本题难度:一般