1、计算题 浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算 :
:
(1)反应后生成硫酸铜的质量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
参考答案:(1)0.1mol
(2)0.2mol/L
本题解析:略
本题难度:简单
2、计算题 已知金属钠投入水中能发生下列反应:2Na + 2H2O =" 2NaOH" + H2↑。若2.3g钠投入足量水中,(1)求生成NaOH 的物质的量;(2)求所生成的H2在标准状况下的体积。
参考答案:0.1mol,1.12L
本题解析:(1)2.3g钠的物质的量是2.3g/23g/mol=0.1mol,根据2Na + 2H2O =" 2NaOH" + H2↑,可知生成的NaOH的物质的量与Na的物质的量之比是1:1,所以生成NaOH的物质的量是0.1mol;
(2)根据化学方程式,生成氢气的物质的量与Na的物质的量之比是1:2,所以生成氢气的物质的量是0.1mol/2=0.05mol,根据V=n×Vm,所以生成的H2在标准状况下的体积是0.05mol×22.4L/mol=1.12L。
考点:考查化学方程式的计算
本题难度:一般
3、计算题 取标准状况下CH4和过量O2的混合气体840 mL点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0. 600 g。 计算:
(1)碱石灰吸收后所剩气体的体积(标准状况下);
(2)原混合气体中CH4与O2的体积比。
参考答案:(1) CH4 +2O2 CO2+2H2O,1 mol CH4完全燃烧得到的CO2和H2O共80 g,
CO2+2H2O,1 mol CH4完全燃烧得到的CO2和H2O共80 g,
原混合气体中n(CH4)=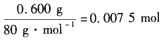 ,
,
CH4的体积为0.0075 mol×22.4× 103 mL/mol=168 mL,
剩余气体的体积=840 mL-3×168 mL =336 mL,
(2)V(CH4):V(O2)=168 mL:( 840 mL - 168 mL) =168 mL:672 mL=1:4
本题解析:
本题难度:一般
4、计算题 全球都在关注人类生产和生活中向大气排放的二氧化碳的量。假设家庭烹饪使用液化石油气,每人每天消耗110g液化气,且液化气成分均以丙烷计。则:
(1)每人每天向大气中排放二氧化碳在标准状况下为多少升?
(2)燃烧中消耗氧气的物质的量为多少?
参考答案:(1)168L? (2)12.5mol;
本题解析:略
本题难度:简单
5、选择题 实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
[? ]
A.950 mL 111.2 g
B.500 mL 117 g
C.1 000 mL 117 g
D.任意规格 111.2 g
参考答案:C
本题解析:
本题难度:简单