1、简答题 A、B、C、D四种物质均由短周期元素组成,其中A、B为酸式盐,B、C、D的焰色反应均呈黄色.相关实验及现象如下:
①取A、B的溶液,分别加入足量的Ba(OH)2溶液,分别产生白色沉淀E、F,加热过滤E后的溶液,有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝;
②向E、F中分别加入足量的稀硝酸,E溶解并产生无色无味的气体,F没有变化;
③向D的溶液中滴入少量B溶液,产生白色沉淀,该沉淀既能溶于过量的B溶液,也能溶于C的溶液.请回答:
(1)写出化学式:B______,C______.
(2)D的溶液呈______(填“酸”、“碱”或“中”)性,其原因是(用离子方程式表示)______.
(3)D溶液中加入少量B溶液时反应的化学方程式为______;
(4)A溶液中加入过量C溶液时反应的离子方程式为______.
参考答案:①取A、B的溶液,分别加入足量的Ba(OH)2溶液,分别产生白色沉淀E、F,加热过滤E后的溶液,有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝,说明有NH3生成;
②向E、F中分别加入足量的稀硝酸,E溶解并产生无色无味的气体,应为CO2,F没有变化,应为BaSO4;
③向D的溶液中滴入少量B溶液,产生白色沉淀,该沉淀既能溶于过量的B溶液,也能溶于C的溶液,该沉淀为Al(OH)3,具有两性,则B为NaHSO4,C为NaOH,A应为NH4HCO3,则D为NaAlO2,
(1)由以上分析可知B为NaHSO4,C为NaOH,故答案为:NaHSO4;NaOH;
(2)D为NaAlO2,为强碱弱酸盐,在溶液中发生AlO2-+2H2O

Al(OH)3+OH-,溶液呈碱性,
故答案为:碱;AlO2-+2H2O

Al(OH)3+OH-;
(3)D为NaAlO2,B为NaHSO4,二者反应的化学方程式为NaHSO4+NaAlO2+H2O═Na2SO4+Al(OH)3↓,
故答案为:NaHSO4+NaAlO2+H2O═Na2SO4+Al(OH)3↓;
(4)A为NH4HCO3,加入过量NaOH,反应的离子方程式为NH4++HCO3-+2OH-═NH3?H2O+CO32-+H2O,
故答案为:NH4++HCO3-+2OH-═NH3?H2O+CO32-+H2O.
本题解析:
本题难度:一般
2、填空题 (12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙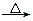 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为? ?。
?。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g)?△H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g)?△H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:? ?。
?。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是?。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4- +
MnO4- +  SO2 +
SO2 +  ??=
??=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g)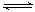 2SO3(g)?△H< 0反应。该反应的化学平衡常数K=?(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是?(填序号)。
2SO3(g)?△H< 0反应。该反应的化学平衡常数K=?(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是?(填序号)。

a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
参考答案:
(1)①C +4HNO3(浓)=CO2 +4 NO2 +2H2O
②N2H4(g) +O2(g)= N2(g)+ 2H2O(g)?△H=-534kj.mol-1
(2)①蓝色晶体变白色粉末?②2MnO4- +5SO2 +2H2O =2Mn2+ +5SO42- +4H+
③K=C2(SO3)/C2(S O2)*C(O2)??C?
O2)*C(O2)??C?
本题解析:略
本题难度:困难
3、填空题 A~F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示:

Ⅰ若A、C、E是氧化物,构成B、D的元素在同一主族,反应①②都是工业上的重要反应,通过反应②可以实现煤的气化,使煤变为清洁能源。
(1)写出反应①的化学方程式?。
(2)用化学方程式表示E在冶金工业上的一种重要用途?。
Ⅱ若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成。
(1)写出D的电子式?。
(2)由A或C转化为E,每消耗1molB,转移电子的物质的量为?mol。
(3)同温同压下,将V 1L A气体和V 2L E气体通入水中,
①若所得溶液的pH=7,则V1_____V2(填“>”或“<”或“=”)。
②若V1=2V2,反应后溶液中各离子浓度由大到小的顺序为?。
参考答案:Ⅰ(1)SiO2+ 2C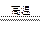 Si+2CO(3分)
Si+2CO(3分)
(2)Fe2O3+3CO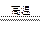 2Fe+3CO2(3分)(其它合理答案也对)
2Fe+3CO2(3分)(其它合理答案也对)
Ⅱ(1)略(2分)
(2)2mol(2分)
(3)①>(2分)?②c(NH4+)>c(Cl-)>c(OH-)>c(H+)(3分)
本题解析:略
本题难度:一般
4、填空题 下列物质间在一定条件下可实现图中所示的一系列变化。其中固体W的焰色反应呈紫色,A是一切生物都不能缺少的气体。

请完成下列问题:
(1)判断X、Y各是什么物质:X________________________,Y________________________。
(2)写出有关反应的化学方程式:
①Z+H2SO4(浓) C:____________;
C:____________;
②W+H2SO4(浓) D+T:____________。
D+T:____________。
参考答案:(1)KClO3? MnO2
(2)①4KCl+MnO2+2H2SO4(浓)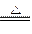 Cl2↑+MnCl2+2K2SO4+2H2O
Cl2↑+MnCl2+2K2SO4+2H2O
②2KCl+H2SO4(浓)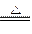 2HCl↑+K2SO4
2HCl↑+K2SO4
本题解析:焰色反应呈紫色的固体W中含有钾,表明X中含有钾;一切生物都不能缺少的气体是O2;Y加热制取O2后未发生变化;则X是KClO3,Y是MnO2,W是KCl。写出MnO2、KCl和浓H2SO4反应的化学方程式,可推知C为Cl2;通过KCl与浓H2SO4反应的化学方程式结合B、C气体点燃生成D,推知D为HCl。最后将各物质代回原框图检查验证。
本题难度:简单
5、推断题 A、B、C、D均为中学化学所学的常见物质,且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他产物已略去):请填写下列空白:
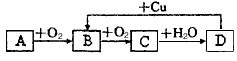
(1)若A为气体单质,则A为____________ ,D→B的离子方程式为 ______________
(2)若A为固体单质,则A为____________ ,A主要用于制造__________________ (任写两种)
(3)若A为气体化合物,其水溶液能使湿润的红色石蕊试纸变蓝,则实验室制取A的化学方程式为__________________________ 。
(4)若A为气体化合物,其水溶液能使湿润的蓝色石蕊试纸变红,则A为_________ ,A与B反应的化学方程式为________________________________ 。
参考答案:(1)N2;3Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O
(2)S;火药、硫酸
(3)Ca(OH)2+2NH4Cl=2NH3↑+ CaCl2+2H2O?
(4)H2S;2H2S+SO2=3S↓+2H2O
本题解析:
本题难度:一般