1、实验题 (12分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A—E为实验室 常见的仪器装置(部分固定夹持装置略去),请根据要求
常见的仪器装置(部分固定夹持装置略去),请根据要求 回答问题。
回答问题。
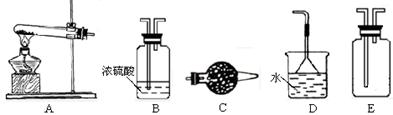
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的 ▲ ?。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
▲ ,写出制纳米级碳酸钙的化学方程式: ▲ ?。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级。
▲ ?。
参考答案:1)ACDE(3分)?
(2)NH3(3分)? CaCl2 + CO2 + 2NH3 + H2O=CaCO3 + 2NH4Cl(3分)
(3)取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是(3分)
本题解析:略
本题难度:一般
2、选择题 下列递变规律正确的是
[? ]
A.P、S、C1最高正价依次降低
B.钠、镁、铝的还原性依次减弱
C.HC1、HBr、HI的稳定性依次增强
D.HC1O、H2SO4、H3PO4的酸性依次增强
参考答案:B
本题解析:
本题难度:一般
3、选择题 核能的和平利用对于完成“节能减排”的目标有着非常重要的意义。尤其是核聚变,因其释放能量大,无污染,成为当前研究的一个热门课题。其反应原理为: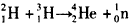 。下列说法中正确的是
。下列说法中正确的是
[? ]
A.D和T是质量数不同,质子数相同的氢的两种元素
B.通常所说的氢元素是指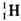
C.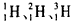 是氢的三种核素,互为同位素
是氢的三种核素,互为同位素
D.这个反应既是核反应,也是化学反应
参考答案:C
本题解析:
本题难度:简单
4、推断题 下表是元素周期表的一部分,A、B、C、D、E、X是表中给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
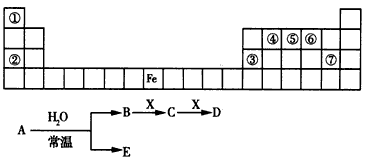
(1)①若E为氧化物,则A与水反应的化学方程式为___________________。
②当X是碱性盐溶液,C分子中有22个电子时,C的电子式为___________。向空气中大量排放C可能导致的后果是_________________。
③当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为________________。
(2)若E为气体单质,D为白色沉淀,A的化学式可能是__________,B含有的化学键类型为_________。
(3)若B为气体单质,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式_________________。
参考答案:(1)①3NO2+H2O=2HNO3+NO;②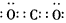 ;使地球温度升高(或温室效应);③Fe+4H++NO3-=Fe3+
;使地球温度升高(或温室效应);③Fe+4H++NO3-=Fe3+
+NO↑+2H2O
(2)Na、Na2O2或NaH;离子键和极性共价键
(3)CO+H2O(g) CO2+H2
CO2+H2
本题解析:
本题难度:一般
5、选择题 下列叙述不正确的是( )
A.NaOH的碱性介于KOH和Mg(OH)2之间
B.Li、Na、K、Rb元素金属性依次增强
C.Na+、Mg2+、Al3+的离子半径依次增大
D.H2SiO3、H2CO3、H2SO4酸性依次增强
参考答案:A.因金属性K>Na>Mg,则NaOH的碱性介于KOH和Mg(OH)2之间,故A正确;
B.Li、Na、K、Rb元素都在ⅠA族,从上到下金属性在增强,故B正确;
C.Na+、Mg2+、Al3+的离子具有相同的电子排布,原子序数大的离子半径小,则Na+、Mg2+、Al3+的离子半径依次减小,故C错误;
D.非金属性Si<C<S,则H2SiO3、H2CO3、H2SO4酸性依次增强,故D正确;
故选C.
本题解析:
本题难度:简单