1、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3?MgO、CaO等,生产工艺流程示意如下:
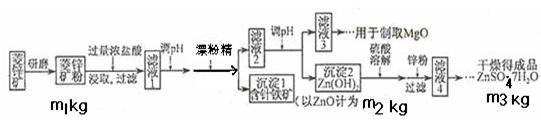
(1)将菱锌矿研磨成粉的目的是____?_,滤液1后两步操作的目是:?。
(2)完成加漂粉精反应的离子方程式:
□Fe(OH)2+□____+□_____ →□Fe(OH)3+□Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
??,?(用文字叙述)
(5) “滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
参考答案:(共12分,每小题2分)1)增大反应物接触面积或增大反应速率或使反应更充分,除去含铁杂质。
(2)2Fe(OH)2+ClO-+H2O? →2Fe(OH)3+Cl-
(3)FeO(OH)(或其它合理答案)
(4)Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH, Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH(任写两个即可)
(5)蒸发浓缩、冷却结晶(或其它合理答案)
(6)125m2/81m1(或其它合理答案)
本题解析:略
本题难度:一般
2、填空题 “绿色化学”要求利用化学原理从源头消除污染,减少或消除在化工产品的设计、生产及应用中有害物质的使用和产生。“绿色化学”要求化学反应和化学工业过程以“原子经济性”为基本原则,在获取新物质的化学反应中充分利用参与反应的原料的每一个原子,实现“零排放”。
(1)下列化学反应符合绿色化学概念的是________。
A.制取有机玻璃的单体: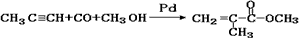
B.制取CuSO4: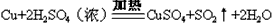
C.制取乙苯: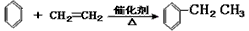 (催化剂是氯化铝,氯化铝和加入的盐酸都有较强的腐蚀性,生产过程中产生大量废液、废气)
(催化剂是氯化铝,氯化铝和加入的盐酸都有较强的腐蚀性,生产过程中产生大量废液、废气)
D.制取Cu(NO3)2:2Cu+O2 2CuO? CuO+2HNO3(稀)=Cu(NO3)2+H2O
2CuO? CuO+2HNO3(稀)=Cu(NO3)2+H2O
(2)化学电池在通讯、交通及日常生活中有着广泛的应用。但废旧电池的妥善处理已成为我们日常生活十分头痛的问题,资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。常用的镍镉电池的总反应可以表示为:Cd+2NiO(OH)+2H2O  2Ni(OH)2+Cd(OH)2 已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。在酸性土壤中这种污染尤为严重。这是因为_______________________。
2Ni(OH)2+Cd(OH)2 已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。在酸性土壤中这种污染尤为严重。这是因为_______________________。
(3)硫酸工业的尾气中主要含有气体,下列有关它的叙述错误的是________。
A.形成硫酸型酸雨
B. 破坏臭氧层
C. 不会腐蚀建筑物
D.能跟血红蛋白结合使人体中毒
E.能使品红、酸性KMnO4褪色,并且褪色原理相同
该尾气我们可采用过量氨水吸收,请写出化学反应方程式________________。请判断这种处理方法是否符合绿色化学的概念___(填“是”或“否”)并说明理由__________________。
参考答案:(1)A D
(2)在酸性土壤中Ni(OH)2和Cd(OH)2都与酸反应,溶解生成了Ni2+、Cd2+,对土壤和水体的污染更严重。
(3)DE;SO2 + 2NH3·H2O=(NH4)2SO3;是;(NH4)2SO3可以继续被氧化生成硫酸铵,而硫酸铵是一种常用的氮肥,既吸收了尾气,又生成了一种有使用价值的化肥。
本题解析:
本题难度:一般
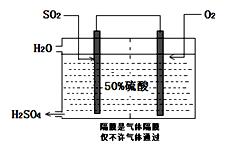
3、填空题 I.目前,我国采用“接触法”制硫酸,设备如图所示:

(1)图中设备A的名称是_____________?该设备中主要反应的化学方程式为?。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生

B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
 氨碱法”中CO2来源于?;
氨碱法”中CO2来源于?;