1、选择题 2008年,中国人民经受了雪灾、震灾等自然灾害的严峻考验,漫长的灾后重建需要大量的钢铁.高炉炼铁中发生的基本反应为Fe2O3+3CO

2Fe+3CO2,为更快更好的生产出优质钢材,下列措施不可行的是( )
A.升高温度
B.建容量大的高炉,增大铁矿石的投入量
C.增大CO的浓度
D.将铁矿石粉碎,尽可能用小块的铁矿石
参考答案:根据题意知,该题是判断化学反应速率的影响因素是否正确.
A、升高温度,无论是放热反应还是吸热反应,化学反应速率都增大,故A正确.
B、固体铁矿石的多少不影响反应速率,也不影响平衡移动,故B错误.
C、增大反应物的浓度,化学反应速率增大,故C正确.
D、铁矿石粉碎,尽可能用小块的铁矿石,增大反应物的接触面积,化学反应速率增大,故D正确.
故选B
本题解析:
本题难度:简单
2、填空题 在容积可变的密闭容器中,可逆反应2HI(g) H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
(1)正反应速率______________;
(2)逆反应速率______________;
(3)平衡______________;
(4)容器内颜色______________;
(5)H2的质量分数______________;
(6)混合气体的平均相对分子质量______________;
(7)H2的浓度______________;
(8)HI的分解率______________;
(9)混合气体的密度______________;
(10)混合气体的质量______________。(用“变大”“变小”“不变”“加深”“变浅”填写)
参考答案:

本题解析:略
本题难度:简单
3、选择题 下列关于反应速率的说法中,错误的是( )
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为零
D.增大反应物浓度,提高反应物温度都能增大反应速率
参考答案:A、化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;
B、反应物本身的性质是决定反应速率的主要因素,如火药爆炸、食物腐败,故B正确;
C、可逆反应达到化学平衡时,正逆反应速率相等,但都不为0,故C错误;
D、增大反应物浓度,活化分子数目增多,反应速率加快;提高反应物温度,活化分子百分数增多,反应速率加快,故D正确;
故选C.
本题解析:
本题难度:一般
4、填空题 室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
实验
编号
| I—的初始浓度
(mol·L-1)
| OCl—的初始浓度
(mol·L-1)
| OH—的初始浓度
(mol·L-1)
| 初始速率v
(mol·L-1· s-1)
|
1
| 2 × 10–3
| 1.5 × 10–3
| 1.00
| 1.8 × 10–4
|
2
| a
| 1.5 × 10–3
| 1.00
| 3.6 × 10–4
|
3
| 2 × 10–3
| 3 × 10–3
| 2.00
| 1.8 × 10–4
|
4
| 4 × 10–3
| 3 × 10–3
| 1.00
| 7.2  × 10–4 × 10–4
|
已 知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为?;
(2)实验2中,a="?" ;
(3)设计实验2和实验4的目的是?;
(4)计算b、c值:b="?" ;c = ?;
= ?;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v="?" 。
参考答案:

本题解析:略
本题难度:简单
5、计算题 二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,达到平衡(NO2浓度约为
0.0125mol·L-1)。下图中的曲线表示二氧化氮分解反应在前20s内的反应进程。

(1)请计算前25s内氧气的平均生成速度。
(2)若反应延续至70s,请在上图中用实线画出25s至70s的反应进程曲线。
(3)若反应开始时加入催化剂(其他条件都不变)请在图上用虚线画出加入催化剂后的反应进程曲线。
参考答案:(1)5.5×10-4mol·L-1·s-1
(2)下图中实线
(3)下图中虚线 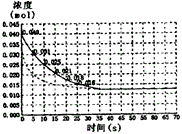
本题解析:
本题难度:一般