1、选择题 某物质的分子式为C2H6O,若要确定其结构,下列方法能实现的是
[? ]
A.质谱法
B.李比希法
C.红外光谱法
D.核磁共振氢谱法
参考答案:CD
本题解析:
本题难度:简单
2、选择题 有机物A经李比希法分析知含C元素70.59%、H元素5.89%,其余为氧元素;质谱法分析得知其相对分子质量为136;核磁共振氢谱中峰面积之比为1:2:2:3;A的某谱图如图。下列说 法正确的是
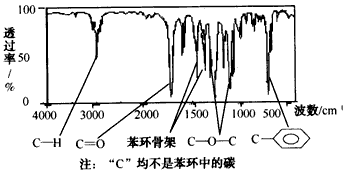
[? ]
A.1mol A完全水解需消耗2mol NaOH
B.A在一定条件下可与4mol H2发生加成反应
C.与A属于同类化合物的同分异构体共有2种(不包括A本身)
D.上图属于红外光谱图
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列叙述中,不正确的是
[? ]
A.在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分数
C.青石棉的化学式为Na2Fe5Si8O22(OH)2,用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
D.红外光谱法可以测定物质的相对分子质量
参考答案:D
本题解析:
本题难度:简单
4、选择题 用NA表示阿伏加德罗常数,下列叙述不正确的是
A.标准状况下,22.4?L?H2含有的分子数为1?NA
B.常温常压下,1.06?g?Na2CO3含有的Na+离子数为0.02?NA
C.常温常压下,48?g?O2和?O3的混合物所含的氧原子数为3?NA
D.物质的量浓度为0.5?mol/L的MgCl2溶液中,含有Cl-个数为1?NA
参考答案:D
本题解析:分析:A、依据气体摩尔体积换算物质的量计算判断;
B、质量换算物质的量结合碳酸钠构成计算分析;
C、依据氧气和臭氧都是氧原子构成,只需要计算氧原子物质的量计算分析判断;
D、溶液体积不知,不能计算微粒数目.
解答:A、标准状况下,22.4?L?H2物质的量为1mol,含有的分子数为1?NA,故A正确;
B、常温常压下,1.06?g?Na2CO3物质的量为0.01mol,含有的Na+离子数为0.02?NA,故B正确;
C、常温常压下,48?g?O2和?O3的混合物中含氧原子物质的量=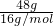 =3mol,所含的氧原子数为3?NA,故C正确;
=3mol,所含的氧原子数为3?NA,故C正确;
D、物质的量浓度为0.5?mol/L的MgCl2溶液中,溶液体积不知,不能计算微粒数目,故D错误;
故选D.
点评:本题考查了气体摩尔体积的体积应用,质量换算物质的量计算微粒数,浓度与微粒数计算关系.
本题难度:简单
5、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定错误的是
A.12.5?mL?16?mol/L浓硫酸与足量铜共热,可生成SO2的分子数约为6.02×1022
B.2.3?g?钠与O2完全反应时,转移电子数约为6.02×1022
C.非标准状况下1.7gNH3体积为2.24?L
D.16.9?g?过氧化钡(BaO2)固体中阴、阳离子总数约为0.2×6.02×1023
参考答案:A
本题解析:分析:A、浓硫酸和过量铜反应,随反应进行浓度变稀后不能与铜反应;
B、质量换算物质的量结合钠最外层电子数为1,分析;
C、非标准状况下0.1mol氨气可能为2.24L;
D、质量换算物质的量,结合过氧化钡是钡离子和过氧根离子构成分析;
解答:A、浓硫酸和过量铜反应,随反应进行浓度变稀后不能与铜反应;12.5 mL 16 mol/L浓硫酸中溶质物质的量0.2mol,与足量铜共热,生成SO2的分子数小于6.02×1022,故A错误;
B、2.3 g 钠物质的量为0.1mol,与O2完全反应时,转移电子数约为6.02×1022,故B正确;
C、非标准状况下1.7gNH3物质的量0.1mol,一定条件下体积可以为2.24 L,故C正确;
D、16.9 g 过氧化钡(BaO2)物质的量=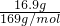 =0.1mol,固体中阴、阳离子是钡离子和过氧根离子,总数约为0.2×6.02×1023,故D正确;
=0.1mol,固体中阴、阳离子是钡离子和过氧根离子,总数约为0.2×6.02×1023,故D正确;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查浓硫酸性质应用,质量换算物质的量计算微粒数,稀硫酸不能和铜反应,过氧化钡是钡离子和过氧根离子构成是解题关键,题目难度中等.
本题难度:一般