1、选择题 A元素的原子最外层(M层)有2个电子,B元素原子最外层(L层)有6个电子,则A和B形成的化合物的式量为?
[? ]
A.56?
B.88?
C.74?
D.40
参考答案:D
本题解析:
本题难度:简单
2、填空题 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
(1)写出N2H62+在碱性溶液中反应的离子方程式____________________。
(2)NH2-的电子式为________________。
(3)N3-有________________个电子。
(4)写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式________________。
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型________________。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是________________。
参考答案:(1)N2H62++2OH-=N2H4+2H2O
(2)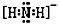
(3)22
(4)N2O、CO2、CNO-、BeF2、CaH2、C3H4等?
(5)直线型
(6)一个单位正电荷
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E是除稀有气体以外的5种短周期元素,原子序数依次增大并分占三个周期.B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数.请回答相关问题:
(1)B元素在周期表中的位置______,C元素是______(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):______
(3)A和D形成的含18电子化合物的化学式为______
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为:______
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:
______.
参考答案:A、B、C、D、E是除稀有气体以外的5种短周期元素,原子序数依次增大并分占三个周期,E原子的电子层数等于最外层电子数,则E为第三周期第ⅢA族元素,即E为Al;
则B、C、D在第二周期,A在第一周期,则A为H元素;B和D的原子序数之比为3:4,B的原子序数为6,B为C元素,D的原子序数为8,D为O元素,然后可知C为N元素,
(1)由上述推断可知,B为C,C为N,B位于第二周期第IVA族,故答案为:第二周期第IVA族;N;?
(2)O、Al的离子具有相同的电子层结构,原子序数大的离子半径小,则离子半径为O2->Al3+,故答案为:O2->Al3+;?
(3)A和D形成的含18电子化合物为H2O2,故答案为:H2O2;
(4)元素E形成的简单离子的水溶液中含有Al3+,C的氢化物的水溶液为氨水,二者的离子反应
为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(5)E2A6化合物为Al2H6,在氧气中燃耗生成氧化铝和水,则化学反应为Al2H6+3O2?点燃?.?Al2O3+3H20,
故答案为:Al2H6+3O2?点燃?.?Al2O3+3H20.
本题解析:
本题难度:一般
4、选择题 X、Y、Z三种元素的原子核外最外层电子数分别为1、4、6,则由这三种元素形成的化合物可能是( )
A.XYZ4
B.X2YZ3
C.XYZ3
D.X2YZ4
参考答案:X、Y、Z三种元素的原子核外最外层电子数分别为1、4、6,,则X的最高化合价为+1价,Y的最高化合价为+4价,Z的最高化合价为+6价,最低化合价为-2价,则
A.XYZ4中Y的化合价为+7价,不符合,故A错误;
B.X2YZ3中Y的化合价为+4价,符合,故B正确;
C.XYZ3中Y的化合价为+5价,不符合,故C错误;
D.X2YZ4中Y的化合价为+6价,不符合,故D错误.
故选B.
本题解析:
本题难度:一般
5、简答题 已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的核外电子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X______;Z______.
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为______、______、______.
(3)由X、Y、Z所形成的常见离子化合物是______,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式______.
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是______.
参考答案:X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.Z原子最外层电子数是次外层电子数的3倍,则Z有2个电子层,最外层电子数为6,故Z为氧元素;Y、Z为同周期的相邻元素,原子序数Y小于Z,故Y为氮元素;W原子的核外电子数等于Y、Z原子最外层电子数之和,故W的核外电子数为5+6=11,故W为钠元素;X、W同主族,四种元素是元素周期表中连续三个短周期的元素,故X为氢元素.
故X为氢元素、Y为氮元素、Z为氧元素、W为钠元素.
(1)由上述分析可知,X为H;Z为O.
故答案为:H;O.
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物为氨气、氧化钠、过氧化钠等.电子式分别为
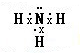
、

、
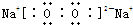
.
故答案为:
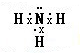
、

、
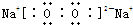
.
(3)X为氢元素、Y为氮元素、Z为氧元素,三元素形成的常见离子化合物是NH4NO3;W为钠元素,W的最高价氧化物的水化物为NaOH,NH4NO3与NaOH浓溶液热时反应生成氨气与水,溶液离子方程式为NH4++OH-?△?.?NH3↑+H2O.
故答案为:NH4NO3;NH4++OH-?△?.?NH3↑+H2O.
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,可以形成分子晶体,如水;可以形成离子晶体,如NaOH;可以形成金属晶体,如钠.不能形成的晶体类型是原子晶体.
故答案为:原子晶体.
本题解析:
本题难度:一般