1、选择题 根据表中部分短周期元素的原子半径和主要化合价信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T
原子半径/nm
0.154
0.118
0.099
0.102
0.073
主要化合价
+1
+3
+7、-1
+6、-2
-2
|
A.氢化物的沸点为:H2T<H2R
B.L和Q形成的化合物中,两种微粒最外层均达到8电子稳定结构
C.单质的还原性顺序:L<M
D.稳定简单离子半径的大小顺序为:L>T>R
参考答案:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,R有+6、-2价,可知R为S元素;Q有+7、-1价,则Q为氯元素;L、M只有正化合价,原子半径L>M>Q,则L为Na元素,M为Al元素.
A、T为O元素,R为S元素;形成的氢化物水分子中存在氢键,沸点较高,故沸点H2T>H2R,故A错误;
B、L为Na元素,Q为氯元素;形成的化合物为氯化钠,氯化钠是离子化合物,由钠离子与氯离子构成,钠离子与氯离子最外层均达到8电子稳定结构,故B正确;
C、L为Na元素,M为Al元素,同周期自左而右金属性减弱,所以金属性Na>Al,金属性越强,单质的还原性越强,单质的还原性顺序:Na>Al,即L>M,故C错误;
D、L为Na元素,T为O元素,R为S元素;三者的简单离子分别为Na+、O2-、S2-,Na+、O2-电子层排布相同,核电荷数越大离子半径越小,所以Na+<O2-,O2-、S2-最外层电子数相同,电子层越多离子半径越大,所以O2-<S2-,所以离子半径Na+<O2-<S2-,即R>T>L,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 同主族元素,其原子结构相同之处是( )
A.最外层电子数
B.核电荷数
C.电子层数
D.核外电子数
参考答案:同主族元素的原子,元素周期表中,原子核外最外层电子数相等,同一主族中,从上到下原子的核电荷数、电子层数和核外电子数逐渐增多,
故选A.
本题解析:
本题难度:一般
3、选择题 短周期元素W、V、T、Z原子序数依次增大,且W、V、T+、Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素).下列关于这些元素的叙述错误的是( )
A.V和其他三种元素均可形成至少2种的二元化合物
B.W和V、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W、V和T三种元素可以形成碱性化合物
D.V、T两元素形成的化合物中只含有离子键
参考答案:CD
本题解析:
本题难度:一般
4、简答题 X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示.
| 元素 | 部分结构知识 | 部分性质
X
X的单质由双原子分子构成,分子中有14个电子
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存
Y
Y原子的次外层电子数等于最外层电子数的一半
Y能形成多种气态氢化物
Z
Z原子的最外层电子数多于4
Z元素的最高正化合价与最低负化合价代数和等于6
W
W原子的最外层电子数等于2n-3(n为原子核外电子层数)
化学反应中W原子易失去最外层电子形成Wn+
|
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X的气态氢化物分子的电子式是______,Z元素在周期表中的位置是______.
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是______.
(3)常温时,W的硫酸盐溶液的pH______7(填“=”、“>”或“<”),理由是:______(用离子方程式表示).
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)______.
(5)25℃、101kPa时,32g?Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式______.
参考答案:X、Y、Z、W是短周期的四种元素:X的单质由双原子分子构成,分子中有14个电子,X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存,故X为氮元素;Y原子的次外层电子数等于最外层电子数的一半,Y有2个电子层,最外层电子数为4,Y能形成多种气态氢化物,则Y为碳元素;Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价代数和等于6,则Z最外层有7个电子,故Z为氯元素;W原子的最外层电子数等于2n-3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,则2n-3=n,解得n=3,则W为铝元素.故X为氮元素;Y为碳元素;Z为氯元素;W为铝元素.
(1)X为氮元素,X的气态氢化物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为
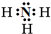
;Z为Cl元素,有3个电子层,最外层有7个电子,在周期表中位于第三周期第ⅦA族,故答案为:
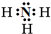
;第三周期第ⅦA族;
(2)X为氮元素、Y为碳元素、Z为氯元素,非金属性越强,最高价氧化物的水化物酸性越强,非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)W的硫酸盐为硫酸铝,硫酸铝是强酸弱碱盐,常温时,铝离子水解?Al3++3H2O

Al(OH)3+3H+,溶液的pH<7,
故答案为:<;?Al3++3H2O

Al(OH)3+3H+;
(4)X的氢化物为NH3,W的氢氧化物为Al(OH)3,用氨水制取Al(OH)3的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(5)25℃、101kPa时,32gCH4的物质的量为2mol,完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,1mol甲烷完全燃烧生成稳定的氧化物时放出890.3kJ的热量,该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3?kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3?kJ/mol.
本题解析:
本题难度:一般
5、选择题 元素性质呈周期性变化根本原因是( )
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.核电荷数逐渐增大
D.元素化合价呈周期性变化
参考答案:B
本题解析:
本题难度:一般