1、选择题 下列说法不正确的是
[? ]
A.25℃时,pH =1的HNO3和pH =1的CH3COOH等体积混合后所得溶液的pH约为1
B.25℃时,Mg(OH)2悬浊液中由Mg(OH)2电离出的c(OH-)≈10-4mol/L,则Mg(OH)2悬浊液的pH约为10
C.25℃pH =a的NaOH溶液和pH=b的NaOH溶液等体积混合pH为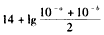
D.25℃时,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该强碱溶液的pH为10.5
参考答案:C
本题解析:
本题难度:一般
2、选择题 常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )
A.b不可能显碱性
B.a可能显酸性或碱性
C.a不可能显酸性
D.b可能显碱性或酸性
参考答案:AB
本题解析:
本题难度:简单
3、选择题 在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A.pH=3的HNO3跟pH=11的KOH溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钠溶液
参考答案:A.硝酸和氢氧化钾都为强电解质完全电离,pH=-lgc(H+),pH=3的HNO3中c(H+)=1×10-3mol/L,pH=11的KOH溶液中,由c(H+)×c(OH-)=10-14可知:c(OH-)=10-1410-11mol/L=1×10-3mol/L,溶液各取1L,等体积混合恰好完全反应,溶液呈中性,故A错误;
B.氨水是弱碱部分电离,pH=3的盐酸c(H+)=1×10-3mol/L,pH=11的氨水c(OH-)=10-1410-11mol/L=1×10-3mol/L,等体积混合,氨水过量,溶液呈碱性,故B错误;
C.pH=3硫酸c(H+)=1×10-3mol/L,pH=11的氢氧化钠溶液c(OH-)=10-1410-11mol/L=1×10-3mol/L,等体积混合恰好完全反应,溶液呈中性,故C错误;
D.醋酸是弱酸部分电离,pH=3的醋酸c(H+)=1×10-3mol/L,pH=11的氢氧化钠溶液c(OH-)=10-1410-11mol/L=1×10-3mol/L,因醋酸为弱酸,二者等体积反应时醋酸过量,溶液呈酸性,pH一定少于7,故D正确;
故选:D.
本题解析:
本题难度:一般
4、选择题 若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为( )
A.10:1
B.5:1
C.1:1
D.1:10
参考答案:B
本题解析:
本题难度:简单
5、简答题 25℃时,0.1mol?L-1的HA溶液中
=1010,0.01mol?L-1的BOH溶液pH=12.请回答下列问题:
(1)HA是______(填“强电解质”或“弱电解质”,下同),BOH是______.
(2)HA的电离方程式是______.
(3)在加水稀释HA的过程中,随着水量的增加而减小的是______(填字母).
A. B. C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体______(填“多”、“少”或“相等”).
参考答案:(1)25℃时,0.1mol?L-1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10-13mol/L,则c(H+)c(OH-)=1012>1010,所以该酸是弱酸;0.01mol?L-1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质,
故答案为:弱电解质;强电解质;
(2)弱酸在水溶液里存在电离平衡,其电离方程式为HA?H++A-,故答案为:HA?H++A-;
(3)A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:n(H+)n(HA)=c(H+)c(HA),所以其比值增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则c(HA)c(A-)减小,故B正确;
C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故选B;
(4)等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多,
故答案为:多.
本题解析:
本题难度:简单