1、选择题 有A、B、C三种气体,若起始时取1 mol A与2 mol B,发生反应A+2B 2C。达到平衡时C(A)、C(B)、C(C)之比与反应速率
2C。达到平衡时C(A)、C(B)、C(C)之比与反应速率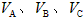 之比恰好相同,则A的平衡转化率为
之比恰好相同,则A的平衡转化率为
[? ]
A.30%
B.40%
C.50%
D.66.7%
参考答案:C
本题解析:
本题难度:一般
2、选择题 化学反应C(s)+H2O(g) CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.加入固体碳,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡向逆反应方向移动动
D.减小压强,平衡向正反应方向移
参考答案:D
本题解析:A、该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率也增大,平衡向正反应方向移动,A不正确;B、碳是固体,加入固体碳,平衡不移动,B不正确;C、加入水蒸气水蒸气浓度增大,平衡向正反应方向移动,C不正确;D、正方应是体积增大的可逆反应,所以减小压强,平衡向正反应方向移,D正确,答案选D。
本题难度:一般
3、选择题 右图表示反应2X(g) Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
化曲线:下列说法正确的是
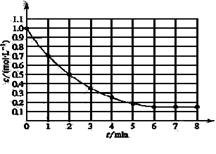
A.2min时X的平均转化率为50%
B.第6min后,反应就停止了
C.若升高温度,X的平衡转化率将减小
D.若减小压强,v正和v逆将以同样倍数减小
参考答案:A
本题解析:根据图像可知,2mion时X的浓度是0.5mol/L,所以X的浓度变化量是1.0mol/L-0.5mol/L-0.5mol/L,因此X的转化率是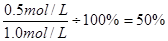 。6min后各种物质的浓度不再发生变化,说明反应达到了平衡状态,反应速率不等于0,反应并没有停止。正反应是吸热反应,所以升高温度平衡向正反应方向移动,X的转化率增大。因为反应前后体积是增大,所以降低压强,正逆反应均减小,但减小的倍数是逆反应速率大于正反应速率,所以平衡向正反应方向移动。答案选A。
。6min后各种物质的浓度不再发生变化,说明反应达到了平衡状态,反应速率不等于0,反应并没有停止。正反应是吸热反应,所以升高温度平衡向正反应方向移动,X的转化率增大。因为反应前后体积是增大,所以降低压强,正逆反应均减小,但减小的倍数是逆反应速率大于正反应速率,所以平衡向正反应方向移动。答案选A。
本题难度:一般
4、选择题
FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl
Fe(SCN)3+3NH4Cl
所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A.向溶液中加入少量KCl晶体
B.向溶液中加入少量的水
C.向溶液中加入少量无水硫酸铜,变蓝后立即取出
D.向溶液中滴加2滴1 mol·L-1的FeCl3(aq)
参考答案:B
本题解析:从反应实质来看,溶液中存在的化学平衡是:
Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
等系列反应。可见加入 KCl 晶体,对此平衡无影响;但加入 2 滴 1 mol·L-1的 FeCl3(aq),使溶液中 Fe3+浓度增大,平衡则向正反应方向移动,溶液颜色变深。A、D 项皆不可选。
对于 B、C 选项,因平衡体系中的水量发生了改变,导致溶液中所有溶质的浓度或同等程度地增大,或同等程度地减小;若要判断平衡移动的方向,从浓度的改变来看,似无从下手。如果我们变换一下思路,将上列平衡体系中的 Fe3+、SCN-和 Fe(SCN)3均虚拟为气态物质(虚拟其状态),则向平衡体系中加水,可认为增大了容器的容积,即减小了气体反应物的压强(或浓度),平衡就向气体体积扩大的方向(即上列反应的逆反应方向)移动,这样液体颜色就会变浅。可见 B 项可选而 C 项不可选。
若采用极限思维,对于 B 选项,可作如下设想:加入的水不是很少而是很多,这样上列平衡体系中,Fe3+与 SCN-相互碰撞结合成 Fe(SCN)3分子的机会越稀越少,而 Fe(SCN)3分子电离成 Fe3+和 SCN-的机会则越来越多,无疑是加水的结果,平衡是向逆反应方向移动的,故而溶液颜色变浅。
本题难度:一般
5、填空题 目前工业上有一种方法是用CO2来生产燃料甲醇。
CO2(g)+3H2(g)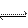 CH3OH(g)+H2O(g)?ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
CH3OH(g)+H2O(g)?ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=?mol/(L·min)。
(2)该反应的平衡常数表达式为?。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是?。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和4 mol H2
 mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为?。
mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为?。