1、填空题 某温度时,在2 L容器中X、Y、Z三种物质随时间的变化曲线如图所示:
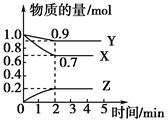
(1)由图中的数据分析,该反应的化学方程式为__________________________。
(2)反应开始至2 min时Z的平均反应速率为____________。
2、填空题 (15分)A、B、C、D、E、W均为短周期元素,原子序数依次增大。回答下列问题:
(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:?。
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)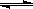 CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。

①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为?。
②图中的P1?P2(填“<”、“>”或“=”),100℃时平衡常数为?。
③在其它条件不变的情况下降低温度,逆反应速率将?(填“增大”、“减小”或“不变”)。
(3)由A、C、D元素原子组成的化合物N2H4和H2O2 有广泛的用途。
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。电池放电时,负极的电极反应式为 ?。
②已知:16 g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75 KJ的热量。 H2O(1)=H2O(g)?△H="+44" kJ·mol-1
2H2O2(1)=2H2O(1)+O2(g)?△H=-196.4 kJ·mol-1
写出N2H4(肼)与氧气反应的热化学方程式为 ? ?。
3、计算题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)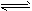 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt (N2)=13mol,nt (NH3)=6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比,(N2)∶(H2)=________。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
4、选择题 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)十B(g)=2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。则用反应物A浓度的减少来表示该反应的速率应为
[? ]
A.0.025 mol/(L·s)
B.0.0125 mol/(L·s)
C.0.05 mol/(L·s)
D.0.1 mol/(L·s)
5、选择题 反应3H2(g) + N2(g) 2NH3(g) ?ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是(?)
2NH3(g) ?ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是(?)
A.随温度升高K增加
B.随压强升高K增加
C.随温度升高K减小
D.随压强升高K减小