1、填空题 某化工厂排出的废水中含有氯气和硫酸,为了除去此废水中的游离氯,并使废水变为中性,供使用的试剂有碳酸钠和亚硫酸钠溶液,试回答:
(1)应先向废水中加入?溶液,离子方程式为?。
(2)然后再向废水中加入?溶液,离子方程式为?。
参考答案:(1)亚硫酸钠? Cl2+2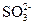 +2H2O
+2H2O 4H++2Cl-+2
4H++2Cl-+2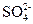 ?
?
(2)碳酸钠?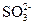 +2H+
+2H+ H2O+CO2↑
H2O+CO2↑
本题解析:用亚硫酸钠除去Cl2会产生H+。要使废水变为中性,应先用Na2SO3溶液除去Cl2,然后再用碳酸钠除去H+。
本题难度:简单
2、选择题 二氧化硫和氯气都有漂白作用,现把二者以等物质的量混合,让混合气体通过湿润的有色布条时,其漂白效果(? )
A.缓慢褪色
B.是二者作用效果之和
C.和单独一种气体通过时相同
D.可能失去漂白作用
参考答案:D
本题解析:当Cl2和SO2以等物质的量混合时,发生反应Cl2+SO2+2H2O====2HCl+H2SO4,有可能会失去漂白作用。
本题难度:简单
3、填空题 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
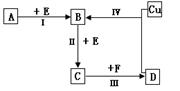
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为?,F分子的电子式为?。
②反应 I 的化学方程式为?。
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质。NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式?。
④ X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 ?。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g·mol–1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于?晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为?。
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式?。
参考答案:(1)①三角锥形(1分)? H:O:H?② 4NH3 + 5O2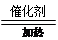 4NO + 6H2O(2分)?③3NaN3 = 4N2↑ + Na3N(2分) ?④6NO2 + 8NH3 = 7N2 + 12H2O或6NO + 4NH3 = 5N2 + 6H2O 或 6NOx + 4xNH3 = (3+2x)N2 + 6xH2O(2分)
4NO + 6H2O(2分)?③3NaN3 = 4N2↑ + Na3N(2分) ?④6NO2 + 8NH3 = 7N2 + 12H2O或6NO + 4NH3 = 5N2 + 6H2O 或 6NOx + 4xNH3 = (3+2x)N2 + 6xH2O(2分)
(2)①离子(1分)?②4FeS2 + 11O2 2Fe2O3 + 8SO2(2分)?③S2– + 4ClO– = SO42– + 4Cl–(2分)
2Fe2O3 + 8SO2(2分)?③S2– + 4ClO– = SO42– + 4Cl–(2分)
本题解析:位于相邻周期、相邻主族、最高价氧化物的水化物均为强酸的两种短周期非金属元素,只能是氮元素和硫元素。
(1)由A的一个分子中都只含有10个电子可知X为是N元素,结合转化关系图可推知A为NH3,B、C、D、E、F分别为NO、NO2、HNO3、O2和H2O。①NH3的空间构型为三角锥形,H2O的电子式为H:O:H。②反应Ⅰ为氨气的催化氧化,生成NO和H2O。③NaX3为NaN3,受撞击后生成Na3N和N2。④氮的氧化物(NO、NO2等)都可以与NH3反应生成无毒害的物质N2和H2O。
(2)Y为硫元素,则B、C、D分别为SO2、SO3和H2SO4,由A+O2→SO2且A的摩尔质量为120g·mol–1可推知A为FeS2(硫铁矿主要成分)。①反应IV为铜与浓硫酸的反应,将溶液蒸干可得到硫酸铜晶体,硫酸铜晶体属于离子晶体。②反应Ⅰ为FeS2与O2反应生成Fe2O3和SO2。③ClO–具有强氧化性,其还原产物为Cl–,因产物无沉淀,所以S2–的氧化产物不是单质硫,只能是SO42–(SO32–还可进一步被氧化),故该反应的离子方程式为:S2– + 4ClO– = SO42– + 4Cl–。
本题难度:一般
4、实验题 (20分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题(由实验装置引起的实验误差忽略不计)。
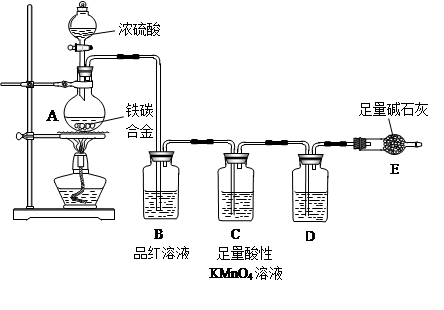
I. 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量;
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸;
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象:
写出A中发生反应的化学方程式___________________________________________(任写一个); B中的现象是________________________________________,由此可得到浓硫 酸具有____________性;C中足量的酸性KMnO4溶液所起的作用是________________________;
D中盛放的试剂是_______________。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
___________________________________(任写一个)。
Ⅱ.测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,则铁碳合金中铁的质量分数为:___________________________________________(写表达式);
某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是_____________________________________________________________________;
(6)经过大家的讨论,决定采用下列装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
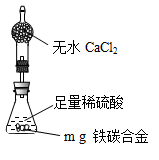
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量
参考答案:⑶2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O(或C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O)(2分);?品红溶液逐渐褪色(2分);?强氧化(2分);?除去CO2中混有的SO2(2分);浓硫酸(2分);
CO2↑+2SO2↑+2H2O)(2分);?品红溶液逐渐褪色(2分);?强氧化(2分);?除去CO2中混有的SO2(2分);浓硫酸(2分);
⑷2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑,SO2+2Fe3++2H2O=2Fe2++SO42-+4H+)(2分);
⑸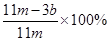 (或
(或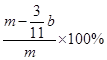 (3分)); 空气中CO2、H2O进入E管使b增大(2分)
(3分)); 空气中CO2、H2O进入E管使b增大(2分)
⑹③(3分)
本题解析:(3)浓硫酸具有强氧化性,能和铁或碳在加热的条件下反应,反应的化学方程式是2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红溶液逐渐褪色,这说明浓硫酸被还原生成了SO2,因此说明浓硫酸具有强氧化性。由于SO2也是一种酸性氧化物,能干扰CO2的检验,所以酸性高锰酸钾溶液的作用是除去CO2中混有的SO2。由于碱石灰也能吸收水蒸气,所以D装置的作用是干燥CO2气体,所以盛放的试剂是浓硫酸。
CO2↑+2SO2↑+2H2O。SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红溶液逐渐褪色,这说明浓硫酸被还原生成了SO2,因此说明浓硫酸具有强氧化性。由于SO2也是一种酸性氧化物,能干扰CO2的检验,所以酸性高锰酸钾溶液的作用是除去CO2中混有的SO2。由于碱石灰也能吸收水蒸气,所以D装置的作用是干燥CO2气体,所以盛放的试剂是浓硫酸。
(4)由于随着反应的进行,稀硫酸的浓度会逐渐降低,所以有可能生成氢气。另外如果铁过量,则氯化铁还可能氧化剩余的单质铁,同时也可能氧化生成的SO2气体,因此可能的离子方程式是2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑,SO2+2Fe3++2H2O=2Fe2++SO42-+4H+)。
(5)E装置增加的质量就是CO2的质量,所以根据碳原子守恒可知,碳的质量是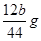 ,则则铁碳合金中铁的质量分数
,则则铁碳合金中铁的质量分数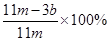 。由于空气中含有水蒸气和CO2,也会加入E装置中,导致b偏大,所以测定结果偏低。
。由于空气中含有水蒸气和CO2,也会加入E装置中,导致b偏大,所以测定结果偏低。
(6)由于气体的体积测量往往受温度和压强的影响,不易测量,①不正确,②态复杂。在反应中碳和稀硫酸不反应,只有铁和稀硫酸反应生成氢气和硫酸亚铁,所以可以根据质量守恒定律,常用实验③。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的--实验原理;3.结合实验材料,初步确定设计对策--实验方案。
本题难度:一般
5、选择题 检验SO2中是否混有CO2气体,可采用的方法是
A.通过品红溶液,若品红溶液褪色,则说明混有CO2气体
B.通过澄清石灰水,若变混浊,则说明混有CO2气体
C.先通过足量NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体
D.先通过足量KMnO4溶液(具有强氧化性),再通过澄清石灰水,若变混浊,则说明混有CO2气体
参考答案:D
本题解析:A不正确,只能说明含有SO2,因为CO2不能使品红溶液褪色。B不正确,因为SO2也能使澄清的石灰水反应,变混浊。C不正确,因为SO2和CO2都能被氢氧化钠溶液吸收。D正确,SO2首先被氧化,排除其干扰,答案选D。
本题难度:一般