1、填空题 (6分)某硫酸厂以硫铁矿为原料生产硫酸,主要过程的化学反应情况如下:
生产过程
| 化学反应
| 反应情况
|
硫铁矿的燃烧
| 4?+11O2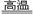 2Fe2O3+8SO2 2Fe2O3+8SO2
| 4%的硫元素损失而混入炉渣
|
SO2的接触氧化
| 2SO2+O2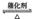 2SO3 2SO3
| SO2转化率为95%
|
SO3的吸收
| SO3+H2O=H2SO4
| SO3的吸收率为98%
|
?(1)将硫铁矿燃烧的化学方程式补充完整:4?+11O2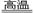 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)该厂现用100吨含硫40%的硫铁矿生产硫酸,可生产98%的浓H2SO4多少吨?(除上述硫的损失外,忽略其它损失)
参考答案:(1)FeS2(2分)? (2)111.72吨(4分)
本题解析:略
本题难度:一般
2、实验题 设计一个只用BaCl2溶液及试管鉴别Na2SO3溶液和稀H2SO4的实验步骤。简要写出操作和实验结论。
参考答案:各取试样适量,分别置于两支试管A、B中。分别向A、B中滴加足量的BaCl2溶液,都生成白色沉淀。静置,将A中上层清液注入B中,若B试管中沉淀溶解且放出有刺激性气味的气体,则说明B中原来加入的是Na2SO3溶液。A试管中则是稀H2SO4;若试管B中无明显现象,则证明试管B中原来加入的是稀H2SO4,试管A中加入的就是Na2SO3溶液。
本题解析:BaCl2溶液与Na2SO3溶液和稀H2SO4反应都生成白色沉淀BaSO3和BaSO4。但前者溶于酸而后者不溶于酸。
本题难度:简单
3、选择题 某同学对一瓶Na2SO3固体样品进行如下实验:取出少量,加水完全溶解,滴入Ba(NO3)2
溶液,产生白色沉淀,再加入足量稀硝酸,仍有白色沉淀剩余。下述叙述正确的是
A.无法确定样品中钠、硫元素的质量比
B.Na2SO3已被氧化
C.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
D.加入稀硝酸后的沉淀一定是BaSO4
参考答案:D
本题解析:A.Na2SO3若不变质,n(Na):n(S)=2:1;若变质,得到的为Na2SO4.n(Na):n(S)=2:1。因此样品中钠、硫元素的质量比为46:32=23:16.错误。B.若未变质,发生反应:Na2SO3+ Ba(NO3)2= BaSO3↓+2NaNO3.再加入足量稀硝酸时,发生反应3BaSO3+ 2HNO3= 3BaSO4↓+2NO↑+ H2O.;若变质为Na2SO4+ Ba(NO3)2= BaSO4↓+2NaNO3.都会产生白色沉淀BaSO4。因此不能确定Na2SO3是否已被氧化,错误。C.根据B的分析可知若未变质,加入Ba(NO3)2溶液后,生成的沉淀中不含有BaSO4。错误。D.无论是否变质,加入稀硝酸后最终得到的沉淀一定是BaSO4。正确。2SO3是否已被氧化变质的现象及操作的知识。
本题难度:一般
4、填空题 用如右图所示气体发生装置可以制取SO2(两种方法)和氯化氢(两种方法)气体,分别写出有关化学反应的化学方程式。
(1)制SO2(氧化还原反应)?;制SO2(复分解反应)?。
(2)制HCl的化学方法:?;制HCl的物理方法:烧瓶中盛?,分液漏斗中盛?。
(3)如果撤去酒精灯,此装置可用于制H2、CO2、H2S及O2,如果用于制O2,烧瓶中盛?,分液漏斗中盛?,所发生反应的化学方程式为?。
参考答案:(1)Cu+2H2SO4(浓) 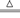 ?CuSO4+SO2↑+2H2O
?CuSO4+SO2↑+2H2O
Na2SO3+H2SO4 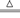 ?Na2SO4+SO2↑+H2O
?Na2SO4+SO2↑+H2O
(2)NaCl+H2SO4(浓) 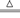 ?NaHSO4+HCl↑
?NaHSO4+HCl↑
浓盐酸?浓H2SO4
(3)MnO2? H2O2? 2H2O2  ?2H2O+O2↑
?2H2O+O2↑
本题解析:(1)浓H2SO4具有强氧化性,与Cu或木炭粉在加热条件下反应被还原为SO2,因此可用浓H2SO4的氧化性来制取SO2。H2SO3不稳定,在加热条件下易分解,可通过强酸制弱酸得到H2SO3,再加热使其分解制SO2。
(2)实验室制取HCl是利用浓H2SO4的高沸点性,NaCl与浓H2SO4在加热条件下制得HCl气体。物理方法制HCl是利用了浓盐酸的挥发性,浓H2SO4吸水有利于HCl的溢出(注意浓H2SO4与其他液体混合时一般是向其他液体中慢慢滴加浓H2SO4)。
(3)实验室制O2是固体与固体在加热条件下的反应,而题目要求撤去酒精灯,因此不能用实验室方法来制取。本题可利用H2O2的不稳定性,易分解来制取O2。
本题难度:简单
5、选择题 下列溶液中,不能区别SO2和CO2气体的是
①石灰水②H2S溶液③KMnO4溶液④溴水⑤酸化的Ba(NO3)2溶液⑥品红溶液
A.只有①
B.②③④⑤
C.①②③⑤
D.①③
参考答案:A
本题解析:SO2和CO2都是酸性氧化物,都具备酸性氧化物的通性,例如都能使澄清都石灰水变混浊。但SO2还具有还原性和漂泊性,所以SO2能使酸性高锰酸钾溶液褪色,也能使品红溶液褪色。在酸性溶液中能被硝酸钡氧化生成硫酸钡沉淀。另外SO2还具有氧化性,能和硫化氢反应生成单质硫沉淀,所以只有①不能鉴别二者,答案选A。
本题难度:简单