1、选择题 X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,Y与M形成的气态化合物在标况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.由X、Y、Z、M四种元素形成的化合物一定有共价键
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物
参考答案:A
本题解析:由题意可知:X是C,Y是N,Z是O,Y与M形成的气态化合物的相对分子质量为:0.76×22.4=17.则M是H,该化合物是NH3。因为W的质子数是X、Y、Z、M四种元素质子数之和的1/2,所以W的质子数是(6+7+8+1)÷2=11.W是Na元素。A.由C、N、O、H四种元素形成的化合物可以是NH4HCO3或(NH4)2CO3.这两种化合物中都含有离子键、共价键。故A选项正确。B.对于电子层数不同的元素来说,电子层数越多,原子半径越大;对于电子层数相同的元素来说,原子的核电荷数越大,原子半径就越小。该原子半径的大小顺序是:Na>C>N>O>H,B选项错误。C.由C元素形成的单质可能是金刚石、石墨、C60等金刚石是原子晶体,石墨是属于过渡型晶体,C60属于分子晶体,C选项错误。D.CO2、C2H2为直线型的共价化合物,Na2O2属于离子化合物,D选项错误。
本题难度:一般
2、选择题 零族元素难以形成化合物的本质原因是
A.它们都是惰性元素
B.它们的化学性质不活泼
C.它们都以单原子分子形式存在
D.它们的原子的电子层结构均为稳定结构
参考答案:D
本题解析:零族元素难以形成化合物的本质原因是最外层都已达到稳定结构,不容易和其它原子化合,故选D。
本题难度:一般
3、填空题 某教师在上《元素周期表》复习课时,组织了一个“介绍自己”的活动:
我们班级中共有44位同学,分为8个小组(学生座位如图所示,数字表示座位号),按从左到右分别为IA、IIA……VIIA、0族,从上到下分别为第一、二……六周期。座位上的每一位同学对应一种元素,请在下列问题中符合要求的同学向大家介绍自己。
| 1 | 2
| ?
| ?
| 讲 台
| ?
| ?
| 3
| 4
|
5
| 6
| 7
| 8
| ?
| 9
| 10
| 11
| 12
|
13
| 14
| 15
| 16
| 17
| 18
| 19
| 20
|
21
| 22
| 23
| 24
| 25
| 26
| 27
| 28
|
29
| 30
| 31
| 32
| 33
| 34
| 35
| 36
|
37
| 38
| 39
| 40
| 41
| 42
| 43
| 44
|
请你一起思考并回答下列问题:
(1)第三周期IVA族的元素对应座位号是 ,原子结构示意图为 。
(2)座位号为22的元素在元素周期表中的位置是 。
(3)比较座位号为18、19对应的元素的非金属性强弱,请用离子方程式表示 。
(4)课堂中有学生提出,这样的安排会导致他们没有对应的元素,则学生对应的座位号是 。
参考答案:(1)16(1分),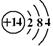 (1分) (2)第四周期IIA族(1分)
(1分) (2)第四周期IIA族(1分)
(3)Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-(2分) (4)2,3(2分)
本题解析:考查元素周期表的结构。
(1)第三周期IVA族的元素是硅,原子序数为14,所以对应的是16,原子结构示意图为 。
。
(2)座位号为22的元素是钙元素,位于第四周期IIA族。
(3)座位号为18、19对应的元素分别是S和Cl,同周期自左向右非金属性直接增强,所以氯元素的强于硫的。比较元素非金属性强弱可用单质之间的相互置换来验证,即Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-。
(4)由于第一周期中只有元素H和He,所以座位号是2、3的没有对应的元素。
本题难度:一般
4、选择题 元素X、Y、Z在周期表中的相对位置如图所示:
已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是(? ? )
A.X元素所在周期中所含非金属元素最多
B.Y元素在周期表的第3周期ⅥA族
C.Y元素原子的外围电子排布为4s24p4
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
参考答案:C
本题解析:Y元素原子的外围电子排布为ns(n-1)np(n+1),则Y是S,所以X是F,Z是As。所以选项C是错误的,其余都是正确的,答案选C。
本题难度:简单
5、填空题 W、X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性
请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示)。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写单质的化学式)、_________(写出化合物的化学式)。
(3) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是_____________________
(4) ZW的电子式为__________,ZW与水反应放出气体的化学方程式为__________________________。
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
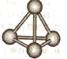
A.X4沸点比P4(白磷)低,属于原子晶体
B.lmol X4气体转变为X2吸收882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知声称1mol水蒸气时放热283.9KJ,写出X2W4 (g)和NO2(g)反应的热化学方程式______________________________________
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4?、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
参考答案:(19分)第二周期ⅥA族(1分),HClO4(1分),S2-> O2->Na+>H+(2分)
(2) O3或Cl2(1分)、ClO2(1分)
(3) H2O (1分),O的非金属性大于S (2分)
(4)  (2分);NaH+H2O==NaOH+H2↑(2分)
(2分);NaH+H2O==NaOH+H2↑(2分)
(5) C(1分)
(6) 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g)?△H = -1135.6KJ/mol(2分,未写状态扣1分,△H未写或计算错误或单位未写扣1分)? N2H4 -4e-+4OH-==N2+4H2O?(2分),负(1分)
本题解析:X的气态氢化物水溶液呈碱性,则X一定是氮元素。Y、M同主族,可形成MY2、MY3两种分子,属于M是S元素,Y是氧元素。W、Z同主族,可形成离子化合物 ZW,则Z是Na,W是H元素。
(1)Y在元素周期表中的位置为第二周期ⅥA族,非金属性越强,最高价氧化物的水化物的酸性越强,则上述元素的最高价氧化物对应的水化物酸性最强的是HClO4。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则W、Y、Z、M形成的简单离子的半径大小顺序是S2-> O2->Na+>H+。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3或Cl2或ClO2。
(3)非金属性越强,氢化物的稳定性越强。O的非金属性大于S,所以水的沸点高于H2S的。
(4)NaH是离子化合物,其电子式为 ,与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑。
,与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑。
(5)X4沸点比P4(白磷)低,属于分子晶体,A不正确;lmol X4气体转变为X2应该是放出167kJ×6-942kJ ×2=882kJ热量,B不正确。由同一种元素形成的不同单质互为同素异形体,C正确,答案选C。
(6)1mol水蒸气时放热283.9KJ,则该反应的热化学方程式是2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g)?△H = -1135.6KJ/mol。原电池中负极失去电子,则该电池负极的电极反应式是N2H4 -4e-+4OH-==N2+4H2O。原电池中阴离子向负极移动。
点评:该题是高考中的常见题型,所以中等难度的试题。试题综合性强,侧重对学生能力的培养和基础性知识的巩固与训练,有助于培养学生的逻辑推理能力和发散思维能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
本题难度:一般