| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《能量的相互转化》考点强化练习(2019年押题版)(四)
 N2(g)+CO2(g) ? N2(g)+CO2(g) ? H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=? (保留两位小数)。 ⑦前10min内用v(NO)表示的化学反应速率为?,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是??。 ③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a ?0(填“>”、“=”或“<”)。 Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。 (1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示 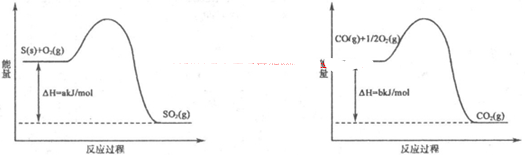 则用SO2除去CO的热化学方程式为?。 (2)高温时,也可以用CO还原MgSO4可制备高纯MgO。 ①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是??。 ②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ?,该电池总反应的离子方程式为?。 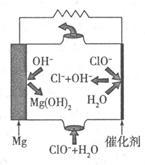 参考答案:I(1)B?(2)① 0.25?② 0.0042mol?L-1?min-1,降低CO2浓度 ③ < 本题解析:I(1)该反应的平衡常数已经很大了,所以提高尾气净化效率关键是加快反应速率。A、 因为该反应为可逆反应,所以装有尾气净化装置的汽车排出的气体中仍然含有NO或CO,错误;B、使用高效催化剂可以加快反应速率,所以提高尾气净化效率的最佳途径是使用高效催化剂,正确;C、增大压强,汽车尾气的排放很难做到,错误;D、升高温度,汽车尾气的排放很难做到,错误。 本题难度:困难 2、选择题 在同温同压下,下列各组热化学方程式中,Q2>Q1的是(?) |
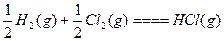 ? ΔH=-Q2 kJ·mol
? ΔH=-Q2 kJ·mol参考答案:C
本题解析:相同物质反应时,影响反应热大小的因素,一是物质数量的多少,二是物质状态。A、B两组属状态不同:A组中因H2O(l)H2O(g)是吸热的,所以Q1>Q2;B组中S(s)S(g)是吸热的,但因其是反应物,故Q1>Q2。C、D两组属反应物的数量不同,量多的放热多,故C正确。
本题难度:简单
3、填空题 (1)已知0.5 mol CH4(g)与0.5 mol 水蒸气在t ℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是
________________________________________________________________________。
(2)已知下列热化学方程式
Zn(s)+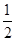 O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
Hg(l)+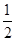 O2(g)===HgO(s) ? ΔH2=-Q2 kJ/mol②
O2(g)===HgO(s) ? ΔH2=-Q2 kJ/mol②
Zn(s)+HgO(s)===Hg(l)+ZnO(s)? ΔH3=-Q3 kJ/mol③
则Q3与Q1和Q2的关系式为:Q3=________。
参考答案:(1)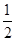 CH4(g)+
CH4(g)+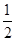 H2O(g)===
H2O(g)===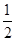 CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol
CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol
(2)Q1-Q2
本题解析:(1)0.5 mol CH4(g)与0.5 mol 水蒸气在t ℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,则该反应的热化学方程式是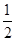 CH4(g)+
CH4(g)+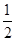 H2O(g)===
H2O(g)===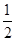 CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol。
CO(g)+H2(g) ΔH(t ℃,p kPa)=+a kJ/mol。
(2)根据盖斯定律可知,①-②即得到 Zn(s)+HgO(s)===Hg(l)+ZnO(s),所以该反应的反应热ΔH3=ΔH1-ΔH2,所以Q3=Q1-Q2。
点评:该题是基础性试题的考查,试题难易适中,注重基础和能力的双向考查,有利于培养学生严谨的逻辑推理能力,提高学生分析问题、解决问题的能力。
本题难度:一般
4、选择题 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是(? )。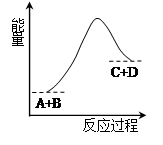
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
参考答案:B
本题解析:根据图像可知,反应物的总能量低于生成物的总能量,所以该反应是吸热反应,选项B正确,AC不正确。反应吸热反应还是放热反应,与反应条件无关系,只与反应物和生成物总能量的相对大小有关系,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练,有利于提高学生灵活运用基础知识解决实际问题的能力,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:简单
5、填空题 (2分)已知
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)? ΔH1="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)? ΔH1="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 ?
参考答案:方程式略?ΔH=+58.73KJ/mol
本题解析:由所给热化学方程式可得到:
①Na2CO3(s)+10H2O(g)=Na2CO3·10H2O(s)? ΔH1=—532.36 kJ·mol-1
②Na2CO3·H2O(s)+9H2O(g)=Na2CO3·10H2O(s)? ΔH1=—473.63 kJ·mol-1
②-①可得:Na2CO3·H2O(s)=Na2CO3(s)+H2O(g)? ΔH=+58.73KJ/mol
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《键参数——键能、.. | |