1、选择题 关于下列四个图像的说法中正确的是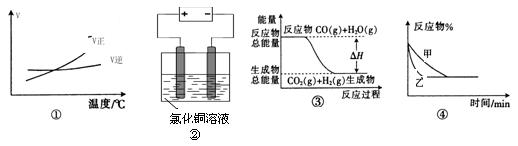

A.图①表示可逆反应“A2(g)+B2(g) 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0

B.图②是在电解氯化铜稀溶液的电解池中,阴、阳极产生气体的物质的量之比一定为1:1

C.图③表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0

D.图④表示压强对可逆反应2A(g)+B(g) 3C(g)+D(s)的影响,甲的压强大
3C(g)+D(s)的影响,甲的压强大
参考答案:C
本题解析:略
本题难度:一般
2、选择题 现有下列一些常见的仪器:①大、小烧杯,②容量瓶,③量筒,④环形玻璃搅拌棒,⑤试管,⑥温度计,⑦蒸发皿,⑧托盘天平。在测定稀盐酸和氢氧化钠稀溶液中和热的实验中,不需要使用的仪器有
A.①②⑥⑦
B.②⑤⑦⑧
C.②③⑦⑧
D.③④⑤⑦
参考答案:B
本题解析:中和热测定实验需要大小烧杯,环形玻璃搅拌棒,量筒,温度计,所以不需要的仪器是②⑤⑦⑧,答案选B。
点评:本题非常简单,主要考查学生的基本实验能力。
本题难度:一般
3、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是?。
(2)已知:

①合成氨的热化学方程式是?。
②降低温度,该反应的化学平衡常数K?.(填“增大”、“减小’’或“不变”)。
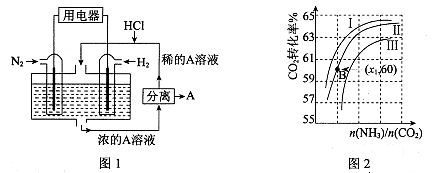
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是?,A是?。
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比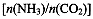 、水碳比
、水碳比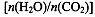 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是?。
②测得B点氨的转化率为40%,则x1?。
参考答案:(13分)
(1)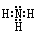 ?(2分)
?(2分)
(2)①N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
②增大
(3)N2+8H++6e-=2NH4+? (2分)? NH4Cl?(2分)
(4)Ⅲ? (1分);? 3?(2分)
本题解析:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是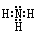
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) ?△H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
本题难度:困难
4、填空题 如图所示,把试管小心地放入盛有(20 ℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL稀盐酸于试管中。试回答下列问题:

(1)实验中观察到的现象是?①镁片上有大量气泡产生;②镁片逐渐溶解;③?。(2)产生上述现象的原因是?
(3)由实验推知,MgCl2溶液和氢气的总能量?(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)③烧杯中液体放出气泡的速率加快
(2)产生上述现象的原因是:镁与盐酸反应产生氢气,该反应为放热反应,碳酸饮料中CO2气体在水中的溶解度随温度的升高而减小,帮烧杯中液体放出气泡的速率逐渐加快。
(3)小于
本题解析:略
本题难度:简单
5、选择题 下列反应中,电子转移数目由多到少排序正确的是(?)
①Cl2+H2O="===HClO+HCl?" ②2F2+2H2O====4HF+O2
③2Na+2H2O====2NaOH+H2↑?④2Al+3Cl2 2AlCl3
2AlCl3
A.①②③④
B.④②③①
C.④③②①
D.②④③①
参考答案:B2+
本题解析:Cl2+H2O====HClO+HCl转移1e-,2F2+2H2O====4HF+O2转移4e-,
2Na+2H2O====2NaOH+H2↑转移2e-,2Al+3Cl2 2AlCl3转移6e-,故B正确。
2AlCl3转移6e-,故B正确。
本题难度:一般