1、选择题 漂白粉在空气中放置易失效的主要原因是
[? ]
A.Ca(ClO)2不稳定,易分解
B.Ca(ClO)2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应
D.Ca(ClO)2跟空气中的CO2反应
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列事实能用同一原理解释的是( )
A.Cl2与Fe、Cu反应生成高价氯化物
B.NH4HCO3晶体、固体I2受热均能变成气体
C.SO2、Cl2均能使品红溶液褪色
D.ClO-与Fe2+、H+均不能大量共存
参考答案:A、氯气具有强氧化性,与金属反应生成最高价态氯化物,故A正确;
B、NH4HCO3晶体分解,固体I2受热升华,前者是化学变化,后者是物理变化,故B错误;
C、SO2能使品红溶液褪色是由于和有色有机物反应生成无色不稳定的物质,由于Cl2和水反应生成具有强氧化性和漂白性的HClO,则Cl2使品红溶液褪色,二者漂白的原理不一样,故C错误;
D、HClO既具有氧化性,又具有弱酸性,ClO-将Fe2+氧化成Fe3+,与H+均反应生成弱电解质HClO,反应原理不同,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是?

A.浓H2SO4? B.NaOH溶液? C.水? D.饱和食盐水
参考答案:B
本题解析:略
本题难度:一般
4、选择题 10g含有杂质的CaCO3和足量的盐酸反应,产生CO20.1mol,则此样品中可能含有的杂质是(? )
A.KHCO3和MgCO3
B.MgCO3和SiO2
C.K2CO3和SiO2
D.无法确定
参考答案:B
本题解析:产生CO20.1mol所需各物质的质量依次为:
CaCO3:10g;KHCO3:10g;MgCO3:8.4g;SiO2:不反应;K2CO3:13.8g;
根据平均值原则,可知,MgCO3和SiO2混合物符合题意,选B
本题难度:简单
5、填空题 如图是实验室中制备气体或验证气体性质的装置图.
(1)仪器a的名称是______.
(2)利用上图装置制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的离子方程式为______.
②装置B中的溶液为______;烧杯中溶液的作用为______.
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2.
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水.
①证明SO2具有漂白性的装置是______,现象是______
②证明SO2具有还原性的现象是______
③证明生成气体中含有CO2的现象是______
④D装置的作用是______.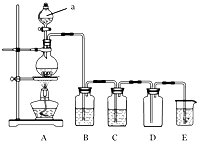
参考答案:(1)装置中a是想烧瓶中加入浓盐酸的仪器为分液漏斗;
故答案为:分液漏斗;
(2)①制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的离子方程式为:MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;
②氯气中含有氯化氢气体和水蒸气,氯化氢也可以被高锰酸钾溶液氧化,需要除去,避免干扰二氧化硫的检验,氯气有毒污染空气不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:饱和NaCl溶液;?吸收氯气防污染;
(3)①证明SO2具有漂白性的装置是B,装置中品红褪色说明生成二氧化硫气体;
故答案为:B;品红褪色;
②证明SO2具有还原性的现象是C装置中的高锰酸钾溶液褪色,还原高锰酸钾溶液表现还原性;
故答案为:C中KMnO4溶液褪色;
③证明生成气体中含有CO2的现象是装置D中 的品红不退色,证明二氧化硫除净,E中石灰水变浑浊证明生成二氧化碳气体;
故答案为:D中品红不褪色且石灰水变浑浊;
④D是检验二氧化硫通过C是否除净的作用;
故答案为:检验SO2是否除尽;
本题解析:
本题难度:一般