1、选择题 铜锌原电池(如下图)工作时,下列叙述正确的是
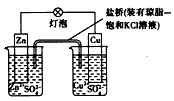
[? ]
A.正极反应为:Zn-2e- = Zn2+
B.电池反应为:Zn +Cu2+ = Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
参考答案:BC
本题解析:
本题难度:一般
2、选择题 根据下图回答,下列说法不正确的是? ( )
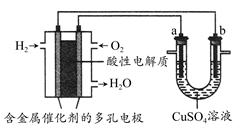
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.燃料电池中正极反应为O2+4e-+4H+=2H2O
C.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼
D.电子经导线流入a电极
参考答案:D
本题解析:电镀铜时阳极为铜,电极反应式为Cu-2e-=Cu2+,负极反应式为Cu2++2e-=Cu,所以A正确;O2得电子,酸性溶液中生成水,所以B正确;a与电源正极相连为阳极,b与电源负极相连为阴极,C正确;电子由a电极流出,D错误。
本题难度:一般
3、选择题 据报道,锌--空气电池将会成为21世纪理想动力源。在碱性溶液中该电池总反应可表示为: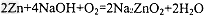 ,下列有关锌--空气电池说法正确的是
,下列有关锌--空气电池说法正确的是
[? ]
A. 每生成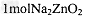 转移4mol电子
转移4mol电子
B. 负极反应式为: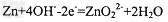 ?
?
C. 电池工作时,溶液中的Na+向负级移动
D. 碱性或酸性电解液中,该电池正极反应式相同
参考答案:B
本题解析:
本题难度:一般
4、填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示
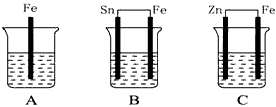
(1)A中反应的离子方程式是____________________。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
参考答案:(1)Fe+2H+==Fe2++H2↑
(2)2H++2e-==H2↑;增大
(3)Zn;Zn+2H+==Zn2++H2↑;B>A>C
本题解析:
本题难度:一般
5、填空题 (7分)如下图所示,烧杯中都盛有稀硫酸。?
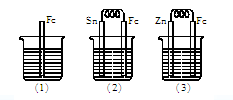
(1)中反应的离子方程式为?。(2分)?
(2)中的电极反应:Fe:?,?Sn:?。?
(3)中被腐蚀的金属是?,其电极反应式为?。?
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是?。
参考答案:(共7分)(1)Fe+2H+==Fe2++H2↑(2分)
(2)Fe-2e-==Fe2+(1分),? 2H++2e-==H2↑(1分)
(3)Zn(1分), Zn-2e-==Zn2+(1分),(2)>(1)>(3)(1分)
本题解析:(1)装置(1)铁中间和稀硫酸反应置换反应,方程式为Fe+2H+==Fe2++H2↑。
(2)装置(2)中铁比锡活泼,所以铁是负极,锡是正极,电极反应式分别是Fe-2e-==Fe2+、2H++2e-==H2↑。
(3)装置(3)中锌比铁活泼,所以锌是负极,铁是正极,因此倍腐蚀的是锌,方程式为Zn-2e-==Zn2+。根据以上分析可知,(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3)。
本题难度:一般