1、选择题 下列电子式中,书写正确的是( )
A.氨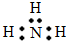
B.氯化氢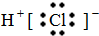
C.氮气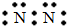
D.氯化镁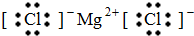
参考答案:A.氮原子为成键的孤对电子未画出,氨气分子中氮原子与氢原子之间形成1对共用电子对,电子式为 ,故A错误;
,故A错误;
B.HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为 ,故B错误;
,故B错误;
C.氮气分子中氮原子之间形成3对共用电子对,电子式为 ,故C错误;
,故C错误;
D.氯化镁属于离子化合物,由镁离子与氯离子构成,电子式为 ,故D正确;
,故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 R原子序数是15,下列关于R元素的说法中,错误的是( )
A.R是第二周期第VA族的元素
B.R的最高正化合价为+5价
C.R的氢化物分子式是RH3
D.R的最高价氧化物对应的水化物的水溶液呈酸性
参考答案:A.R为P元素,位于元素周期表中的第三周期第ⅤA族,故A错误;
B.第ⅤA族元素的最高价为+5价,故B正确;
C.P元素的最低价为-3价,则R的氢化物分子式是RH3,故C正确;
D.P元素的最高价为+5价,为非金属元素,则R的最高价氧化物对应的水化物的水溶液呈酸性,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 以下各组粒子不能互称为等电子体的是(?)
A.CO和N2
B.N2H4和C2H4
C.O3和SO2
D.CO2和N2O
参考答案:B
本题解析:价电子数和原子数分别都相等的物质是等电子体,选项B中价电子数不同,不能是等电子体,其余都是正确的,答案选B。
本题难度:简单
4、选择题 下列说法不正确的是( ? )
A.NH4NO3、NaOH中既有离子键,又有极性共价键,其中NH4NO3中还有配位键
B.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是水分子间有氢键
C.范德华力与氢键可同时存在于分子之间
D.氢键比范德华力强,且氢键是一种特殊的化学键
参考答案:D
本题解析:
本题难度:简单
5、填空题 ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
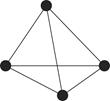
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。
(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
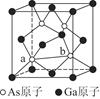
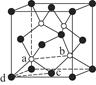
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
参考答案:(1)N>P>As
(2)3s23p63d10
(3)CO2或CS2或N2O(任写一种,写成SiO2等原子晶体形式不正确)
(4)sp3
(5)①V形或角形或折线形
②6
(6)是
(7)
 c(说明:如图所示,平行四边形abcd中ab=cd=
c(说明:如图所示,平行四边形abcd中ab=cd= c)
c)
本题解析:(1)同一主族元素的原子半径越大,越易失去电子,电离能越小。(3)等电子体指原子总数相等,价电子总数相等的粒子。(4)白磷分子中每个P原子有一个孤电子对,形成了3个σ键,故采取sp3杂化。(5)NO2-中氮原子的孤电子对数为 (5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,NO2-为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×
(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,NO2-为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8× +6×
+6× =4,则晶体密度为
=4,则晶体密度为 =
= ?g·cm-3=
?g·cm-3= g·cm-3。
g·cm-3。
本题难度:一般