|
高中化学知识点归纳《物质的量浓度》高频试题特训(2019年最新版)(八)
2019-06-28 20:30:20
【 大 中 小】
|
1、选择题 如图是某盐酸试剂瓶标签的部分内容.据此判定下列说法正确的是( )
A.该试剂的物质的量浓度为1.2?mol/L
B.该盐酸50?mL与足量MnO2反应可得标况下的氯气3.36?L
C.配制200?mL?3?mol/L的稀盐酸需该盐酸50?mL
D.该盐酸与等体积水混合所得溶液的质量分数小于18.25%
| 
参考答案:A、c=103ρwM=103×1.2×36.5%36.5mol/L=12?mol/L,故A错误;
B、根据MnO2+4HCl(浓)?△?.? MnCl2+Cl2↑+2H2O及MnO2与稀盐酸不反应可知,随反应的进行,浓盐酸变为稀盐酸,生成氯气的体积小于0.05L×12mol/L×0.25×22.4L/mol=3.36?L,故B错误;
C、根据配制溶液前后溶质的物质的量不变可知,需取该硫酸的体积为3mol/L×0.2L12mol/L=0.05L=50mL,故C正确;
D、水的密度比盐酸的密度小,等体积混合时,盐酸的质量大于水的质量,所以该盐酸与等体积的水混合所得溶液的质量分数大于18.25%,故D错误;
故选C.
本题解析:
本题难度:简单
2、实验题 实验室配制 500 mL 0.2 mol/L CuSO4溶液,实验操作步骤有:
①用天平称量蓝矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL 容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加少量蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)在天平上称出胆矾的质量为________g。
(2)操作步骤的正确顺序为________(填序号)。
(3)若出现如下情况,所配溶液浓度将有何影响?(填偏高、偏低或无影响)
a.没有进行操作步骤④时,会_______________;
b.定容时俯视刻度线,会__________________。
(4)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应________________。
参考答案:(1)25.0;
(2)①②④③⑤
(3)偏低;偏高
(4)重新配制
本题解析:
本题难度:一般
3、实验题 实验室欲用NaOH 固体配制1.0 mol/L的NaOH溶液240 mL
(1)配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动 其正确的操作顺序为_________(填编号)。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、_____________。
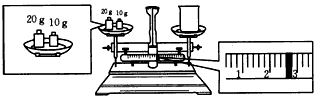
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为____g,要完成本实验该同学应称出____g NaOH。
(3)使用容量瓶前必须进行的一步操作是_____________________
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是____。
A.转移溶液时有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
参考答案:(1)②①③⑧⑤⑥⑨⑦④;250mL容量瓶
(2)27.4;10
(3)查漏
(4)BC
本题解析:
本题难度:一般
4、填空题 在无土栽培中,配制1L内含0.5molNH4+、0.64molCl-、0.56molK+、______molSO42-的某中性营养液,若用KCl、NH4Cl、______配制,则需这三种固体的物质的量分别为0.56mol、0.08mol、______mol.
参考答案:根据溶液中电荷守恒有:n(NH4+)+n(K+)=n(Cl-)+2n(SO42-),即0.5mol+0.56mol=0.64mol+2n(SO42-),解得n(SO42-)=0.21mol;
0.56molKCl、0.08molNH4Cl含有的NH4+、Cl-、K+的物质的量分别为0.08mol,0.64mol,0.56mol;
而溶液中NH4+、Cl-、K+、SO42-的物质的量分别为0.5mol,0.64mol,0.56mol,0.21mol,所以还缺少0.42molNH4+、0.21molSO42-,即需要0.21mol(NH4)2SO4;
故答案为:0.21;(NH4)2SO4;0.21;
本题解析:
本题难度:简单
5、简答题 用98%的浓H2SO4(ρ=1.84g/cm3)配制480mL0.5mol/L的稀H2SO4,请按要求填空:
(1)所用浓H2SO4的物质的量浓度为______,配制时所需浓硫酸的体积为______.
(2)实验中需要用到的定量仪器有______.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容______;
②定容时俯视刻度线______;
(4)若定容时液面高于刻度线应采取的措施是______.
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你帮助把标签上的内容写一下(如右图).
参考答案:(1)浓H2SO4的物质的量浓度c=1000×1.84×98%98mol/L=18.4mol/L,
配制480mL0.2mol/L的稀H2SO4,需选择500mL容量瓶,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL.
故答案为:18.4mol/L;?13.6mL;
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用20mL量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
所以需要的仪器为:玻璃棒、烧杯、胶头滴管、20?mL量筒、500mL容量瓶,
故答案为:20?mL量筒、500mL容量瓶;
(3)①浓硫酸溶解后未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,所配溶液浓度偏高,故答案为:偏高;
②定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高,故答案为:偏高;
(4)定容时液面高于刻度线应导致所配溶液浓度偏低,应宣告实验失败,洗净容量瓶后重新配制,故答案为:应宣告实验失败,洗净容量瓶后重新配制;
(5)标签上的内容应写出物质的名称和浓度,
故答案为:

.
本题解析:
本题难度:一般
| 