1、填空题 现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
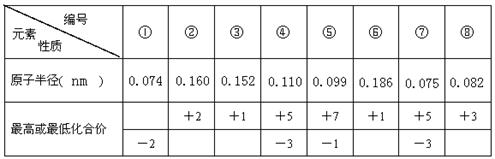
回答下列问题:
(1)①在元素周期表中的位置是(周期、族)?;
(2)比较④和⑦的氢化物的稳定性(用化学式表示)?。
参考答案:(4分)(1)第二周期第Ⅵ A族;(2分)(2)NH3>PH3(2分)
本题解析:电子层越多,半径越大,同周期从左向右原子半径在减小,最高正价在增大,最高正价等于族序数,由短周期元素的数据可知,①为O,②为Mg,③为Li,④为P,⑤为Cl,⑥为Na,⑦为N,⑧为B,
(1)①为O,在元素周期表中的位置是第二周期第Ⅵ A族。
(2)④⑦同主族,④的原子半径大,则原子序数大,④和⑦的氢化物的稳定性是NH3>PH3。考点:
点评:本题考查原子结构与元素周期律,熟悉原子半径、化合价的变化规律是解答本题的关键,题目难度不大,⑧为学生解答的易错点。
本题难度:一般
2、填空题 短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)画出D元素的原子结构示意图??。C、D、E的简单离子半径由小到大的顺序?(用离子符号表示)。
(2)写出元素E在周期表中的位置?。
(3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是?。
(4)D2C2与H2O反应的化学方程式是?,D2C2与CuSO4溶液反应的现象是?。
(5)由元素A、B、C按原子个数比4:2:3形成的化合物,写出其电离方程式:?。
参考答案:(1)?,? Al3+<Na+<O2-?
(2)第三周期,ⅢA族?
(3)用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在
(4)2Na2O2 + 2H2O =" 4NaOH" + O2↑?、?产生蓝色沉淀并有气泡放出
(5)NH4NO3=NH4+ + NO3-
本题解析:A元素阳离子的原子核外没有电子,所以A是H元素;B是空气中含量最多的元素,所以B是N元素;C元素原子最外层电子数是其电子层数的三倍,则C只能是2层电子,最外层6个电子,则C是O元素;C与D可形成两种常见的离子化合物,则D是Na元素;工业上常用电解C与E的化合物来制备E单质,工业常电解氧化铝来制备铝单质,所以E是Al元素。
(1)Na的原子结构示意图为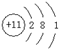
氧离子、钠离子与铝离子的核外电子排布相同,核电荷数越少,半径越大,所以C、D、E的简单离子半径由小到大的顺序是Al3+<Na+<O2-
(2)Al元素位于元素周期表的第三周期,ⅢA族;
(3)A和B的单质合成一种常见气体,该气体是氨气,检验氨气的方法是用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在;
(4)过氧化钠与H2O反应的化学方程式是2Na2O2 + 2H2O =" 4NaOH" + O2↑;过氧化钠与水反应的产物又与CuSO4溶液反应,所以有气体放出,同时溶液中产生蓝色沉淀;
(5)由元素H、N、O按原子个数比4:2:3形成的化合物是硝酸铵,硝酸铵是强电解质,完全电离,电离方程式为NH4NO3=NH4+ + NO3-
本题难度:一般
3、选择题 X元素原子的最外层电子数与次外层电子数的差值等于电子层数;Y元素原子比X元素原子的最外层电子数多2。则X与Y所形成的化合物为(? )
A.X3Y2
B.X2Y
C.XY2
D.XY3
参考答案:C
本题解析:因原子最外层电子数≤8,所以,X原子的次外层只能为2,即X原子有两个电子层,设最外层电子数为m,则m-2=2,m=4;由此可知,Y原子最外层有6个电子。二者只能形成选项C中的化合物XY2。
本题难度:简单
4、选择题 下列叙述不正确的是
A.热稳定性:纯碱>石灰石>小苏打>碳酸
B.除Li外其它碱金属单质均可以保存在煤油中
C.碱金属都是活泼的金属元素,其盐都不发生水解
D.最高氧化物对应水化物碱性LiOH<NaOH<KOH<RbOH<CsOH
参考答案:C
本题解析:
答案:C
A、正确,热稳定性:纯碱(加热不分解)>石灰石(高温分解)>小苏打(加热分解)>碳酸(常温下不稳定)
B.正确,除Li外其它碱金属单质均可以保存在煤油中,Li密度比煤油小,保存在石蜡中;
C.不正确,碱金属都是活泼的金属元素,其盐弱酸盐可发生水解,如:Na2CO3
D. 正确,同主族元素的金属性从上增强,最高氧化物对应水化物碱性增强:LiOH<NaOH<KOH<RbOH<CsOH
本题难度:一般
5、选择题 关于同一种元素的原子或离子,下列叙述正确的是(?)。
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子比带正电荷少的阳离子半径大
参考答案:A
本题解析:同一元素微粒的半径大小顺序为r阴>r原>r阳,价态高的阳离子半径小,所以选A。
本题难度:简单