1、选择题 下列说法中正确的是(?)
①水分子的电子式为H+ 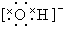
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为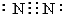
④只含有离子键的化合物才是离子化合物
A.①②
B.③④
C.①④
D.②③
参考答案:D
本题解析:水是共价化合物,电子式为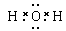 ,①不正确。电子层结构相同的离子,离子半径随原子序数的递增而减小,②正确。氮气中的化学键是三键,③正确。只要含有离子键就是离子化合物,所以离子化合物中可以含有共价键,④不正确。答案选D。
,①不正确。电子层结构相同的离子,离子半径随原子序数的递增而减小,②正确。氮气中的化学键是三键,③正确。只要含有离子键就是离子化合物,所以离子化合物中可以含有共价键,④不正确。答案选D。
本题难度:简单
2、选择题 最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的不正确叙述是(?)
A.14C与12C60中碳原子化学性质相同?
B.14C与14N的质量数相同
C.14C是12C60的同素异形体?
D.14C与12C、13C互为同位素
参考答案:C
本题解析:A、14C与12C60的碳原子化学性质相同,故A叙述正确;
B、14C与14N原子中质量数相同。故B叙述正确。
C、14C是原子,12C60是分子,所以不是同素异形体,故C叙述不正确;
D、14C与12C、13C是具有相同质子数不同中子数的同元素的不同原子,互称为同位素.故D叙述正确;
故选C。
点评:本题考查同位素、同素异形体的概念,理解各微粒间的关系和含义即可判断,较简单。
本题难度:一般
3、选择题 下列判断错误的是
A.沸点:NH3>PH3>AsH3
B.稳定性:HF>HCl>HBr>HI
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
参考答案:A
本题解析:由于氨气分之间存在氢键,所以氨气的沸点在同主族元素的氢化物中沸点最高,其余的自上而下逐渐降低,所以选项A不正确,应该是NH3>AsH3>PH3。非金属性越强,相应氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,B、C正确。同样金属性越强,最高价氧化物的水化物的碱性越强,D正确,答案选A。
本题难度:简单
4、填空题 (13分)下图是元素周期表的一部分,其中所列字母分别代表某一元素
a
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| b
|
j
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| c
| d
| ?
| ?
|
?
| e
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| f
| ?
| ?
| g
| h
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| i
| ?
| ?
| ?
| ?
| ?
| k
| ?
| ?
| ?
| ?
|
(1)写出元素k基态原子的核外电子排布式________________________。
(2)e、f单质及ef形成的合金的硬度由大到小的顺序为_______________________(用具体名称回答)
(3)用来组成酸、碱、盐三类物质至少需要的元素有___________________(用表中列出元素的化学式填写)
(4)短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第?族。
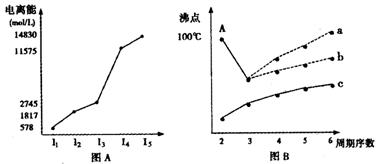
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第?族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:折线a和折线b,你认为正确的是?。
参考答案:(13分)
(1)1s22s22p63s23p63d104s24p2……(2分)
(2)镁铝合金>铝>镁……(2分)
(3)N、O、H ……(3分,每种一分,答错倒扣分)
(4)ⅢA……(2分)?ⅣA… …(2分)? b……(2分)
本题解析:略
本题难度:一般
5、填空题 海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序?(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是
?键。
参考答案:Na>Cl?共价键(2分)
本题解析:海水中含量最多的四种元素,除了O、H外,还有钠和氯元素,其中原子半径最大的是Na,即另外二种元素的原子半径由大到小的顺序Na>Cl。由于只有一种金属元素,所以任意三种元素组成的物质中肯定含有共价键。
点评:该题是基础性试题的考查,难度不大。旨在考查学生对元素周期律以及化学键知识的熟悉了解程度,有利于提高学生的学习效率和应试能力。
本题难度:一般