1、选择题 能正确表示下列反应的离子方程式是?
[? ]
A.将铜屑加入 ?溶液中:
?溶液中: ?
?
B.将磁性氧化铁溶于盐酸: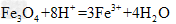 ?
?
C.将氯化亚铁溶液和稀硝酸混合: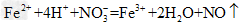 ?
?
D.将铁粉加入稀硫酸中:
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列离子方程式书写正确的是?( )
A.氢氧化钡溶液与明矾溶液混合,Ba2+刚好完全沉淀:
3Ba2++60H-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.AgNO3溶液中加入过量氨水:Ag++NH3?H2O=AgOH↓+NH4+
C.FeBr2溶液中按物质的量之比1:1通入Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.向Ca(ClO)2溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
参考答案:A、氢氧化钡溶液与明矾溶液混合,Ba2+刚好完全沉淀时的离子方程式为:2Ba2++40H-+Al3++2SO42-=2BaSO4↓+[Al(OH)3],故A错误;
B、AgNO3溶液中加入过量氨水可以制的氢氧化银铵这一溶液,即Ag++4NH3?H2O=[Ag(NH3)3]++OH-+NH4+,故B错误;
C、FeBr2溶液中按物质的量之比1:1通入Cl2时,亚铁离子全部被氧化,溴离子部分被氧化,即2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故C正确;
D、CaSO3具有还原性,HClO具有氧化性,二者仍能发生氧化还原反应,故D错误.
故选C.
本题解析:
本题难度:简单
3、实验题 (15分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下。
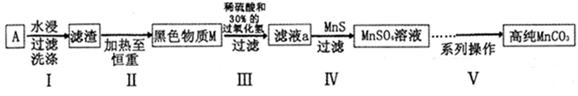
(1)碱性锌锰干电池的负极材料是?(填化学式)。
(2) 第I步操作得滤渣的成分是?;第Ⅱ步操作的目的是?。
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为?。
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为?。
(已知:Ksp(MnS)=2.5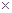 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6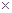 10-24)
10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,l00oC时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7;?操作2:过滤,用少量水洗涤2~3次;
操作3:检测滤液;?操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①试剂X是?;
②操作3中,说明SO42-已除干净的方法是?。
参考答案:(1)Zn。(2)MnO2和炭粉;除去炭粉。(3)MnO2+H2O2+H2SO4 MnSO4+2O2+H2O;
MnSO4+2O2+H2O;
(4)MnS+Zn2+ ZnS+Mn2+。(5)①Na2CO3;②取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
ZnS+Mn2+。(5)①Na2CO3;②取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
本题解析:根据题给信息和工艺流程知,黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,MnO2和炭粉不溶于水,经水浸、过滤、洗涤得滤渣的成分是MnO2和炭粉;MnO2和炭粉加热至恒重,碳粉与空气中的氧气反应生成碳的氧化物而除去,黑色物质M的主要成分为MnO2,MnO2与硫酸、双氧水反应生成硫酸锰、氧气和水,经过系列操作的高纯MnCO3。(1)根据教材知识知,碱性锌锰干电池的负极材料是Zn。(2) 由上述分析知,第I步操作得滤渣的成分是MnO2和炭粉;第Ⅱ步操作的目的是除去炭粉。(3)MnO2与硫酸、双氧水反应生成硫酸锰、氧气和水,该反应的化学方程式为MnO2+H2O2+H2SO4 MnSO4+2O2+H2O。(4)由Ksp(MnS)=2.5
MnSO4+2O2+H2O。(4)由Ksp(MnS)=2.5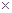 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6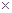 10-24知,ZnS比MnS更难溶,利用沉淀的转化除去Zn2+的离子方程式为MnS+Zn2+
10-24知,ZnS比MnS更难溶,利用沉淀的转化除去Zn2+的离子方程式为MnS+Zn2+ ZnS+Mn2+。 (5)第V步系列操作由硫酸锰制得高纯MnCO3。①试剂X是Na2CO3;②操作3为检验沉淀是否洗涤干净,说明SO42-已除干净的方法是取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
ZnS+Mn2+。 (5)第V步系列操作由硫酸锰制得高纯MnCO3。①试剂X是Na2CO3;②操作3为检验沉淀是否洗涤干净,说明SO42-已除干净的方法是取最后一次洗涤液少量置于试管中,加入硝酸钡,若无白色沉淀生成,说明SO42-已除干净。
本题难度:一般
4、选择题 下列文字表述与反应方程式对应且正确的是
A.过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:
HCO+Ba2++OH-===BaCO3↓+H2O
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O
D.硫化钠水溶液呈碱性:S2-+H2O HS-+OH-
HS-+OH-
参考答案:BD
本题解析:
过氧化钠在离子反应中应保留化学式,过氧化钠和水反应的离子反应为2Na2O2+2H2O=4Na++4OH-+O2—,故A错;Al3+ +3NH3.H2O=Al(OH)3↓+3NH4+
氨水是弱碱,不能使Al(OH)3溶解成AlO2-盐,故C错;含等物质的量的KHCO3和Ba(OH)2溶液混合,其化学方程式:KHCO3+Ba(OH)2=KOH+H2O+BaCO3↓
其离子方程式:HCO3- + Ba2+ + OH- =" BaCO3↓" + H2O,故B正确;硫离子(S2-)由于水解显碱性发生反应S2-+H2O~~HS-+OH-.由于水解常数较大,所以生成的OH-相对较多,碱性较强,D正确。故选BD。
本题难度:一般
5、简答题 将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).
(1)O点溶液中所含溶质的化学式为______,
(2)O到a点发生反应的离子方程式:______.
(3)标准状况下通入CO2气体的体积为______L,NaOH溶液的物质的量浓度为______mol?L-1.
参考答案:(1)Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,HCl与Na2CO3、NaHCO3都按1:1反应,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故溶液中溶质为NaOH、Na2CO3,故答案为:NaOH、Na2CO3;
(2)根据(1)分析可知,O到a点发生反应为:氢离子与氢氧根离子反应生成水,氢离子与碳酸根反应生成碳酸氢根,发生的离子反应为:H++OH-=H2O、CO32-+H+=HCO3-,
故答案为:H++OH-=H2O、CO32-+H+=HCO3-;
(3)由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为2mol,由方程式可知产生二氧化碳的物质的量为2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,故开始通入的二氧化碳的体积为2mol×22.4L/mol=44.8L,
加入5molNaCL生成二氧化碳体积最大,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),根据钠离子守恒有n(NaOH)=n(NaCl),故n(NaOH)=n(HCl)=5mL,所以c(NaOH)5mol2L=2.5mol/L,
故答案为:44.8;2.5.
本题解析:
本题难度:一般