1、推断题 下图中的物质均由前20号元素组成,常温下A为液体,E、G、H、I、J、K、L、M为气体,且G、I、J 为单质;E与M反应的产物是工业上合成某种塑料的单体。
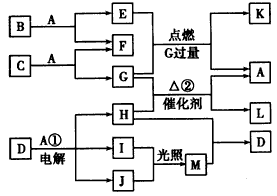
(1)A~L中,含有极性键的非极性分子为____________(填化 学式)。
(2)反应①中阴极反应的电极反应式为________________。
(3)反应②中若有0.2 mol H参加反应,则转移电子的物质的量为___________。
(4)E的燃烧热为1300 kJ/mol,写出表示E的燃烧热的热化学方程式____________________。
(5)若E与G恰好完全反应,则B与C的物质的量之比为____________。
参考答案:(1)CO2、C2H2
(2)2NH4++2e-=2NH3↑+H2↑或2H2O+2e-=H2↑+2OH-,NH4++OH-= H2O + NH3↑或 2H+ +2e-= H2↑,
NH4++OH- = H2O + NH3↑
(3)1 mol
(4)C2H2(g)+5/2O2(g)=2CO2(g)+H2O(1) △H = -1 300 kJ/mol
(5)1:5
本题解析:
本题难度:一般
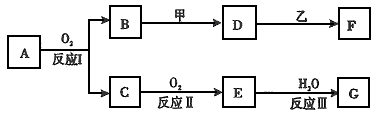
2、推断题 物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。
则: ①反应Ⅲ的化学方程为________________。
②D与乙反应的离子方程式为________________ 。
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。
则: ①工业上,反应 I的化学方程式为________________ 生产设备名称为:__________
②D和乙反应的离子方程式为______________________
③ 请简述检验D溶液中阳离子的方法_________________ 。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________ (列出计算式即可)。
参考答案:(1)①3NO2+H2O==NO+2HNO3
②2Al+2OH-+2H2O?== 2AlO2-+3H2↑
(2)① 4FeS2+11O2==2Fe2O3+8SO2(反应条件:高温); 沸腾炉?
②2Fe3+ + Fe ==3Fe2+?
③取少量G溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子?
④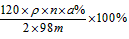
本题解析:
本题难度:一般
3、简答题 已知有以下物质相互转化:
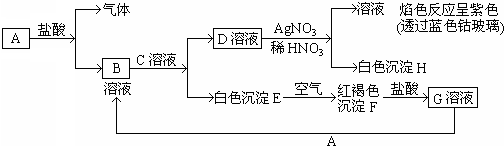
试回答:
(1)写出B的化学式______D的化学式______.
(2)写出由E转变成F的化学方程式______.
(3)写出用KSCN鉴别G溶液的离子方程式______;向G溶液加入A的有关离子反应方程式______.
参考答案:D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾.
(1)通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl2、KCl,故答案为:FeCl2;KCl;
(2)E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为:4Fe?(OH)2+O2+2H2O═4Fe?(OH)3,
故答案为:4Fe?(OH)2+O2+2H2O═4Fe?(OH)3;
(3)铁离子和硫氰根离子反应生成硫氰化铁,离子反应方程式为:Fe3++3SCN-═Fe?(SCN)3 ,铁离子和铁反应生成亚铁离子,离子反应方程式为:2Fe3++Fe═3Fe2+,
故答案为:Fe3++3SCN-═Fe(SCN)3;2Fe3++Fe═3Fe2+.
本题解析:
本题难度:一般
4、选择题 有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验.
(1)逐滴加入6mol?L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液
(2)加热试管中的白色粉末,试管口有水滴凝结
(3)逐滴加入6mol?L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物
下列混合物中符合以上实验现象的是( )
A.NaHCO3、AgNO3
B.BaCl2、MgCO3
C.NH4HCO3、MgCl2
D.CaCl2?6H2O、Na2CO3
参考答案:D
本题解析:
本题难度:一般
5、填空题 有关元素X、Y、Z、W的信息如下:

请回答下列问题:
(1) Y的单质在空气 中充分燃烧所得氧化物的电子式________________
中充分燃烧所得氧化物的电子式________________
(2) X、Y、W的简单离子的半径由大到小的是_______________ (写离子符号)
(3) 向淀粉碘化钾溶液中滴加几滴 的浓溶液,现象为______________ ,
的浓溶液,现象为______________ ,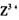 基态离子的电子排布式为?
基态离子的电子排布式为?
(4) 以 溶液为原料制取无水
溶液为原料制取无水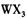 ,主要操作包括加热浓缩、冷却结晶、过滤,先制得
,主要操作包括加热浓缩、冷却结晶、过滤,先制得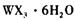 晶体,然后在条件下加热
晶体,然后在条件下加热 晶体,能进一步制取无水
晶体,能进一步制取无水 .其原因是(结合离子方程式简要说明)? _____________________________________________
.其原因是(结合离子方程式简要说明)? _____________________________________________
参考答案:(12分)

本题解析:略
本题难度:一般