1、选择题 某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00? mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1
D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1
参考答案:D
本题解析:根据实验①判断,原溶液中一定有Mg2+,无NH4+。参加反应的OHˉ: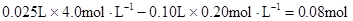 ,n(Mg2+)=
,n(Mg2+)=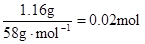 ? Mg2+ + 2OHˉ= Mg(OH)2↓,与Mg2+反应的OHˉ:
? Mg2+ + 2OHˉ= Mg(OH)2↓,与Mg2+反应的OHˉ: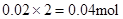 ,所以原溶液中一定存在Al3+。与Al3+反应的OHˉ:
,所以原溶液中一定存在Al3+。与Al3+反应的OHˉ: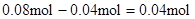 ,因滤液中还余OHˉ,则发生反应?Al3+ + 4OHˉ= AlO2ˉ + 2H2O ,n(Al3+ )=
,因滤液中还余OHˉ,则发生反应?Al3+ + 4OHˉ= AlO2ˉ + 2H2O ,n(Al3+ )= 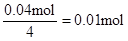 ;由实验②结合上面的计算数据,得 n(Clˉ)=
;由实验②结合上面的计算数据,得 n(Clˉ)=  ;? n(Clˉ)>2n(Mg2+) + 3n(Al3+ ) 所以原溶液中还含有 Na+ ?;2n(Mg2+) + 3n(Al3+ )+ n(Na+ ) =
;? n(Clˉ)>2n(Mg2+) + 3n(Al3+ ) 所以原溶液中还含有 Na+ ?;2n(Mg2+) + 3n(Al3+ )+ n(Na+ ) = 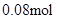 ?n(Na+ ) =
?n(Na+ ) = 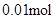
原溶液中离子的浓度:
c (Clˉ) =  ?c (Al3+)=
?c (Al3+)=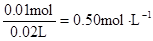
c (Mg2+)=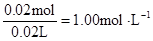 ? c(Na+ )=
? c(Na+ )= 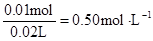
故选D。
本题难度:一般
2、填空题 有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、 、
、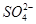 、Cl-、I-、
、Cl-、I-、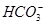 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
实验步骤
| 实验现象
|
①取少量该溶液,加几滴甲基橙溶液
| 溶液变红色
|
②取少量该溶液,加入铜片和浓硫酸,加热
| 有无色气体产生,遇空气可以变成红棕色
|
③取少量该溶液,加入BaCl2溶液
| 有白色沉淀生成
|
④取③中的上层清液,加入AgNO3溶液
| 有稳定的白色沉淀生成,且不溶于稀硝酸
|
⑤取少量该溶液,加入NaOH溶液
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解
|
由此判断:
(1)溶液中一定存在的离子是?;溶液中肯定不存在的离子是?。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)?。
(3)写出实验⑤中所有反应的离子方程式:?。
参考答案:(1) 、
、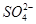 、Mg2+、Al3+Fe2+、
、Mg2+、Al3+Fe2+、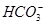 、I-、Ba2+
、I-、Ba2+
(2)K+的检验可以用焰色反应;Cl-的检验:向溶液中加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,再加稀硝酸,若生成白色沉淀不溶解,则证明有Cl-
(3)H++OH-=H2O Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=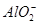 +2H2O
+2H2O
本题解析:原溶液无色,则其中不含有Fe2+;实验①说明溶液呈酸性,所以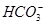 不能大量存在;实验②说明溶液中含有
不能大量存在;实验②说明溶液中含有 ,因为I-能被HNO3氧化,所以I-不能大量存在;实验③说明原溶液中含有
,因为I-能被HNO3氧化,所以I-不能大量存在;实验③说明原溶液中含有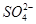 ,则肯定不含Ba2+;实验④无法说明原溶液中是否含有Cl-,因为实验③引入了Cl-;实验⑤说明溶液中含有Mg2+和Al3+。
,则肯定不含Ba2+;实验④无法说明原溶液中是否含有Cl-,因为实验③引入了Cl-;实验⑤说明溶液中含有Mg2+和Al3+。
本题难度:一般
3、选择题 常温下,某溶液中由水电离产生的c(H+)与c(OH-)满足c(H+)-c(OH-)=10-24,则下列各离子组在该溶液中一定可以大量共存的是( )
A.K+Na+C6H5O-Cl-
B.Na+Cl-SO42- S2O32-
C.K+C2O42- MnO4- SO42-
D.Ba2+Na+Cl-NO3-
参考答案:溶液中由水电离产生的c(H+)与c(OH-)相等,由c(H+)?c(OH-)=10-24,则由水电离生成的c(H+)=c(OH-)=10-12,即水的电离受到抑制,溶液可能为酸或碱溶液,
A.酸溶液中,氢离子与C6H5O-结合生成弱酸苯酚,则不能共存,故A不选;
B.酸溶液中,氢离子与S2O32-结合生成硫、二氧化硫,则不能共存,故B不选;
C.酸溶液中,C2O42-、MnO4-发生氧化还原反应,则不能共存,故C不选;
D.无论酸或碱溶液,该组离子之间不反应,则能大量共存,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 下列说法错误的是
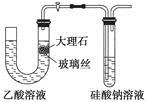
A.使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3)
B.0.1 mol·L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动
C.等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大
D.等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少
参考答案:A
本题解析:由于乙酸具有挥发性,而图示中没有除杂装置,故无法比较它们的电离常数,选项A错;根据勒夏特列原理可知选项B正确;根据水解原理——“越弱越易水解”可知选项C正确;选项D可用作图法得出是正确的。
本题难度:一般
5、选择题 某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂污水不含相同的离子):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂污水单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变得无色澄清,溶质主要为硝酸钠,污染程度大大降低。下列关于污染源的分析,你认为正确的是
[? ]
A.Na+和NO3-来自同一工厂
B.Cl-和NO3-一定在同一工厂
C.Ag+和Na+可能在同一工厂
D.SO42-和OH-一定来自同一工厂
参考答案:D
本题解析:
本题难度:一般