1、简答题 配制400mL0.1mol/L的Na2CO3溶液:
(1)计算:需无水Na2CO3______g.?(2)称量:用天平称量无水Na2CO3______g.
(3)溶所需仪器______.
(4)转移:将烧杯中的溶液沿______小心地引流到______中.
(5)定容:当往容量瓶里加蒸馏水时,距刻度线______cm处停止,为避免加水的体积
过多,改用______加蒸馏水到溶液的______正好与刻度线______,这个操作叫做定容.
(6)不能配制任意体积的一定物质的量浓度的溶液,这是因为______.
(7)溶液注入容量瓶前需恢复到室温,这是因为______.
(8)用胶头滴管定容后再振荡,出现液面底于刻度线时不要再加水,这是因为______.
(9)如果加水定容时超出了刻度线,不能将超出部分再吸走,须______.
(10)如果摇匀时不小心洒出几滴,不能再加水至刻度,必须重新配制,这是因为______.
(11)溶质溶解后转移至容量瓶时,必须用少量蒸馏水将烧杯及玻璃棒洗涤2-3次,并将洗涤液一并倒入容量瓶,这是因为______.
参考答案:(1)m=nM=CVM=0.1mol/L×0.5L×106g/mol=5.3g.
故答案为:5.3;
(2)称量固体碳酸钠5.3g.
故答案为:5.3;
(3)烧杯盛放固体碳酸钠,玻璃棒搅拌加速溶解.
故答案为:烧杯、玻璃棒.
(4)转移:将烧杯中的溶液沿玻璃棒小心地引流到 容量瓶中.
故答案为:玻璃棒;容量瓶.
(5)定容:当往容量瓶里加蒸馏水时,距刻度线 1-2cm处停止,为避免加水的体积过多,改用胶头滴管加蒸馏水到溶液的 凹液面正好与刻度线 相切,这个操作叫做定容.
故答案为:1-2;胶头滴管;凹液面;相切.
(6)容量瓶上没有刻度,只有固定容积的容量瓶,所以不能配制任意体积的一定物质的量浓度的溶液.
故答案为:容量瓶的容积固定.
(7)溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高.
故答案为:溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高.
(8)用胶头滴管定容后再振荡,出现液面底于刻度线时不要再加水,这是因为再加水导致溶液的体积偏大,配制溶液的浓度偏小.
故答案为:再加水导致溶液的体积偏大,配制溶液的浓度偏小.
(9)如果加水定容时超出了刻度线,不能将超出部分再吸走,如果将超出部分再吸走导致溶质的物质的量偏小,配制溶液的浓度偏低,须重新配制.
故答案为:重新配制.
(10)如果摇匀时不小心洒出几滴,不能再加水至刻度,必须重新配制,因为再加水至刻度导致溶质的物质的量偏小,配制溶液的浓度偏低.
故答案为:再加水至刻度导致溶质的物质的量偏小,配制溶液的浓度偏低.
(11)如果不将洗涤液倒入容量瓶会导致溶质的物质的量偏小,配制溶液的浓度偏低.
故答案为:如果不将洗涤液倒入容量瓶会导致溶质的物质的量偏小,配制溶液的浓度偏低.
本题解析:
本题难度:一般
2、填空题 实验室用98%、密度为1.84g/cm3的硫酸,配制浓度为0.46mol/L的稀硫酸溶液200mL.
(1)下面为实验过程中部分操作,正确的顺序为______
①用量筒量取浓硫酸;②洗涤烧杯和玻璃棒3次并将洗涤液转移到容量瓶内;③振荡摇匀;
④稀释浓硫酸;⑤用胶头滴管加水至刻度;⑥将稀释后的稀硫酸转入容量瓶
(2)回答下列问题
①稀释浓硫酸的操作:______;
②用量筒量取浓硫酸______mL;
③量取浓硫酸的体积时,如果仰视读数,则配制的稀硫酸的物质的量浓度偏______(高或低).
参考答案:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以实验操作步骤的正确顺序为①④⑥②⑤③.
故答案为:①④⑥②⑤③.
(2))①稀释浓硫酸的操作:将浓硫酸沿着烧杯壁慢慢注入水中,并不断搅拌.
故答案为:将浓硫酸沿着烧杯壁慢慢注入水中,并不断搅拌.
②98%、密度为1.84g/cm3的硫酸的物质的量浓度为1000×1.84×98%98=18.4mol/L,实验室200mL容量瓶不常见,选择250ml容量瓶.令需浓硫酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以V×18.4mol/L=250mL×0.46mol/L,解得:V=6.3ml.
故答案为:6.3.?
③量取浓硫酸的体积时,如果仰视读数,量取的浓硫酸的体积偏大,配制的稀硫酸的物质的量浓度偏高.
故答案为:高.
本题解析:
本题难度:一般
3、选择题 配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是
[? ]
A.容量瓶使用前有少量蒸馏水
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.在转移过程中有溶液撒在外面
D.定容时俯视确定凹液面与刻度线相切
参考答案:D
本题解析:
本题难度:简单
4、选择题 如图所示操作正确的是?
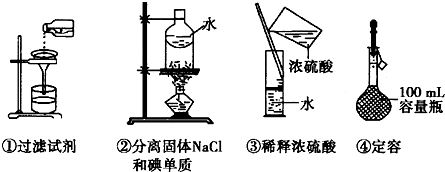
A.只有②
B.②③
C.③④
D.②③④全部错误
参考答案:A
本题解析:分析:①过滤时,要注意一贴二低三靠的原则;
②根据碘易升华而氯化钠加热不挥发;
③根据浓硫酸的稀释方法进行分析判断;
④根据胶头滴管的使用方法.
解答:①过滤液体时,应通过玻璃棒引流,同时漏斗的下端紧靠烧杯内壁,故①错误;
②分离氯化钠和单质碘可用升华的方法,故②正确;
③稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;不能在量筒中稀释,故③错误;
④定容时胶头滴管在滴加液体时不能伸入容量瓶,故④错误;
故选A.
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.
本题难度:一般
5、填空题 实验室要求配制500mL?0.1mol-L-1Na2CO3溶液.请回答下列问题:
(1)应用托盘天平称取Na2CO3-10H2O______g
(2)用托盘天平和小烧杯称量碳酸钠晶体的质量,正确操作顺序的标号为______(同一步骤可用多次).
A.调整零点
B.将游码移至刻度尺的零刻度处
C.将碳酸钠晶体放人小烧杯中称量
D.称量空的小烧杯
E.将砝码放回砝码盒内
F.记录称量的结果
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、烧杯、药匙、______、______、______.
(4)若实验中遇到下列情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
A.定容时加水时超过刻度线:______.
B.洗涤液未移入容量瓶:______.
C.容量瓶内壁附有水珠而未于燥:______.
D.定容时俯视刻度线:______.
参考答案:(1)实验室配制500mL0.1mol/LNa2CO3溶液需要Na2CO3的物质的量为:0.5L×0.1mol/L=0.05mol,Na2CO3?10H2O的物质的量为0.05mol,Na2CO3?10H2O的质量为:0.05mol×286g/mol=14.3g,故答案为:14.3;
(2)用天平称量物体时的正确操作步骤是:先将游码移至刻度尺的零刻度处并调零点,然后先称量空的小烧杯的质量,记录称量的结果,将碳酸钠晶体放入小烧杯中称量,记录称量的结果,将砝码放回砝码盒内,最后将游码移至刻度尺的零刻度处,故答案为:BADFCFEB;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;玻璃棒;胶头滴管;
(4)A.定容时加水时超过刻度线,溶液体积偏大,配制浓度偏低;
B.洗涤液未移入容量瓶,会造成溶质损失,使配制溶液浓度偏低;
C.容量瓶内壁附有水珠而未干燥,对溶质和溶剂都无影响,所以配制浓度无影响;
D.定容时俯视刻度线,导致水量不足,造成溶液浓度偏高;
故答案为:偏低;偏低;无影响;偏高.
本题解析:
本题难度:一般