1、选择题 关于实验下列说法错误的是(?)
A.在硫酸铜晶体结晶水含量的 测定实验中,加热后的硫酸铜应在空气中冷却后
测定实验中,加热后的硫酸铜应在空气中冷却后 再称量
再称量
B.在中和热的测定实验中,应用稀的强酸和强碱作为反应物进行实验
C.在Fe(OH)3胶体的电泳实验中,靠近阴极附近的液体的颜色会加深
D.在硫酸铜晶体结晶水含量的测定实验中,加热不够充分将会使实验结果偏小
参考答案:A
本题解析:
本题难度:简单
2、实验题 (14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题:
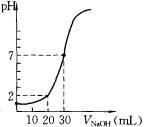
(1)有关滴定的操作可分解为如下几步,并补充完整。①用NaOH溶液润洗滴定管。②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL。③?④调节液面至“0”或“0”刻度以下,记下读数。⑤移取10.00 mL盐酸注入锥形瓶中,加入酚酞。⑥把锥形瓶放在滴定管的下面,用氢氧化钠溶液滴定并记下读数。
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果?(填“偏高”“偏低”或“不变”)。
(3)如用酚酞作指示剂,则滴定终点的实验现象是?。
(4)c(HCl)=??mol·L-1
(5)c(NaOH) =??mol·L-1
(6)右图表示50 mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)?。
A.是a mL
B.是(50-a)mL
C.一定大于a mL
D.一定大于(50-a)mL
(7)常温下,用0.01 mol?L-1H2SO4溶液滴定0.01 mol?L-1 NaOH溶液,中和后加水至100 ml。若滴定到终点时少加一滴H2SO4(设1滴为0.05 ml)。则此时溶液的pH为?。
参考答案:(1)调节滴定管尖嘴使之充满溶液(2)偏低?
(3)最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去
(4)0.09?(5)0.03?(6)D?(7)9
本题解析:(1)碱式滴定管在装入标准液后需要调节滴定管尖嘴使之充满溶液。
(2)滴定管自上而下刻度线是逐渐增大的,所以滴定前俯视滴定管读数,读数是偏小的,则企氢氧化钠的体积偏大,结果就偏低。
(3)由于是氢氧化钠滴定盐酸,所以终点时的现象是最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去。
(4)根据图像可知,当加入2ml氢氧化钠时,溶液的pH是1。终点时消耗氢氧化钠的体积是30mol,所以盐酸的浓度是氢氧化钠的3倍,则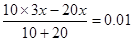 ,解得x=0.03mol/L,所以盐酸的浓度是0.09mol/L。
,解得x=0.03mol/L,所以盐酸的浓度是0.09mol/L。
(5)见(4)
(6)由于滴定管的最下端是不带刻度线的,所以滴定管中溶液的体积应大于(50-a)mL。
(7)一滴硫酸中氢离子的物质的量是0.05 ml×10-3×2×0.01 mol/L=10-6mol/L,所以过量的氢氧化钠是10-6mol/L,因此c(OH-)=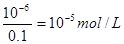 ,则氢离子浓度是10-9mol/L,pH等于9.
,则氢离子浓度是10-9mol/L,pH等于9.
本题难度:一般
3、选择题
下列实验操作及现象与预期实验目的或实验结论不一致的是(?)
选项
| 实验操作及现象
| 实验目的或结论
|
A
| 向盐酸中滴加水玻璃,用激光笔照射,有丁达尔现象
| 说明有硅酸胶体生成
|
B
| 蔗糖溶液中加入稀硫酸,加热,再加入少量银氨溶液,加热,无银镜生成
| 说明蔗糖未发生水解
|
C
| 浓硫酸和乙醇混合后加热,将产生的混合气体(C2H4、CO2、SO2等)通入酸性高锰酸钾溶液,溶液褪色
| 说明有乙烯产生
|
D
| 在新制的氨水中加入碳酸钙粉末,充分搅拦后,过滤
| 提高氯水中HClO的浓度
参考答案:B
本题解析:
本题难度:简单
4、实验题 利用铝热反应焊接钢轨的原理是2Al+Fe2O3 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入?溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有??;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
实验操作
| 预期现象和结论
|  步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。
| ?
| 步骤2:将步骤1的滤渣转移到烧杯B中,加入足量?,充分搅拌,过滤,洗涤。
| 有红色固体生成,说明粉末中含有
?。
| 步骤3:将步骤2的滤渣转移到烧杯C中,
?
?。
| ?
?
?,
说明粉末中含有Fe2O3。(1分)
|
?
参考答案:(1) NaOH (1分)? (2) Fe2O3
(3)(10分)
实验操作
预期现象和结论
步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。
?
步骤2:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤。
有红色固体生成,说明粉末中含有Fe。(1分)
步骤3:将步骤3的滤渣转移到烧杯C中,加入足量3mol/L HCl,充分搅拌,再滴加少量20%KSCN。(2分)
固体部分溶解,溶液变血红色,说明粉末中含有Fe2O3。(1分)
本题解析:考查铝、铁及其化合物的性质及检验,铝热反应涉及物质无所谓是铁铝两金属单质及其对应的氧化物
(1)通过实验结论可知,通过该步骤来检验铝及其氧化物的存在:一般是通过用NaOH碱液来检验,涉及反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O,可通过是否有气体生成来判定是否有铝,固体是否溶解来判定是否有Al2O3
(2)Fe、Fe2O3、Al2O3三种物质中,已经确定Al2O3的存在,那么固体的组成无所谓就是三种情况:①Fe2O3、Al2O3②Fe、Al2O3③Fe、Fe2O3、Al2O3
(3)实验的主要目的是确定Fe、Fe2O3是否存在,依据所给部分信息可知
步骤1当然是溶解除去Al2O3
步骤2:结论有红色固体生成,说明是生成了铜,可知原样品中一定含有铁,将可溶性铜盐(最常用的就是硫酸铜溶液)置换所致
步骤3:很明显本步骤是要检验Fe2O3的存在,对于三价铁的检验,一般用KSCN溶液,故可用酸液将滤渣溶解后用KSCN来观察是否有血红色现象产生即可
点评:本题本质是对铁、铝及其化合物的检验,起点高,但落点较低,都是日常学生常见的习题;但综合性较高
本题难度:一般
5、实验题 (8分)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1.2 mol,试完成下列问题:
(1)烃A的分子式是_________。
(2)若取一定量的烃A充分燃烧后,生成B、C各3 mol,则有_________g的A参加了反应,燃烧时消耗标准状况下的氧气_________ L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式是___________。
(4)若烃A能使溴水褪色,在催化剂作用下与H2发生加成反应后生成2,2-二甲基丁烷,则烃A的名称是_________,结构简式是_________。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有_________种。
参考答案:(1)C6H12? (2)42? 100.8? (3)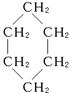
(4)3,3-二甲基-1-丁烯 ?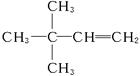 ?(5)3 ?(5)3
本题解析:(1)据题设条件求得A的分子式为C6H12。(3)C6H12可能是烯烃,也可能是环烷烃,因为烃A不能使溴水褪色,说明烃A属于环烷烃,所以C6H12为环己烷,其结构简式为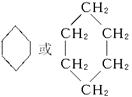 。 。
(4)若烃A能使溴水褪色,说明C6H12为烯烃,加氢生成物为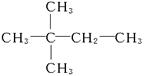 ,则烃A应为 ,则烃A应为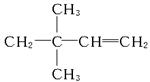 ,名称为3,3,-二甲基-1-丁烯。 ,名称为3,3,-二甲基-1-丁烯。
(5)同分异构体中,属烯烃的有
CH3—CH2—CH==CH2,CH3—CH==CH—CH3,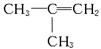 3种。 3种。
本题难度:简单
|