1、实验题 (11分)下图虚线框中的装置可用来检验浓硫酸与木炭加热条件下反应产生的所有气体产物
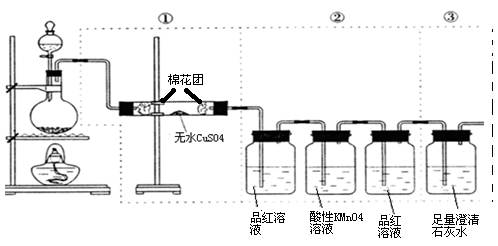
(1) 写出木炭粉与浓硫酸反应的化学方程式?
(2) 如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是_______?_____;不能检出的物质是______?______。
(3) 如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_?__;不能检出的物质是___?_。
(4) 如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____?__;不能检出的物质是_?___
参考答案:(11分)
⑴? C + 2H2SO4(浓)= CO2↑ + 2SO2↑ + 2H2O? (2分)
⑵CO2、SO2 (2分)? H2O? (1分)
⑶H2O? (1分)? CO2? SO2 (2分)
⑷CO2? SO2 (2分)? H2O? (1分)
本题解析:略
本题难度:一般
2、实验题 (9分)某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如右图所示装置。实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。

(1)为防止空气污染,请补画右图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式:
?。
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
?。
(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的?(填写字母序号):
A.铁粉
B.BaCl2溶液
C.银粉
D.Na2CO3溶液
参考答案:

本题解析:(1)为防止空气污染,应有尾气吸收装置,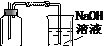
(2)写出铜跟浓硫酸反应的化学方程式:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
铜只与浓硫酸反应,随着反应的进行,浓硫酸变为稀硫酸,铜就不在反应,所以,溶液中肯定有稀硫酸存在。
(4)为证明反应结束后的烧瓶中确有余酸,可选用的药品是铁粉、Na2CO3溶液。加入铁粉,如果铁粉溶解并有气泡产生,证明有余酸。加入Na2CO3溶液,如果有气泡产生,证明有余酸。故选A D。
本题难度:简单
3、选择题 下列说法中正确的是:
[?]
①只要能源充足而且价格低廉,废弃物中的原子都可以成为有用物质的原料
②化学家能合成大量自然界中并不存在的新物质、新材料
③学习化学不限于书本和实验室,成功的关键在于如何激发自己对于自然现象的兴趣
④实验是学习化学、体验化学和探究化学过程的重要途径
A.③④
B.①③④
C.②③④
D.①②③④
参考答案:D
本题解析:
本题难度:简单
4、实验题 (12分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:
①该反应的气体产物是CO2;
②该反应的气体产物是CO;
③该反应的气体产物是?。
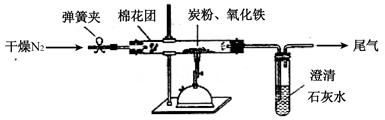
(2)计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:?。
(4)实验步骤:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为?。
(5)数据处理:
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
?。
(6)实验优化:
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是?。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:
?。
参考答案:⑴CO2、CO的混合物
⑶NH4++NO2—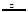 N2↑+2H2O
N2↑+2H2O
⑷步骤②中是为了排除空气中的CO2,步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3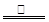 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
本题解析:(1)根据极端假设可知还有一种情况就是两者的混合物,即CO2、CO的混合物。
(3)用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液制氮气反应的离子方程式为:NH4++NO2—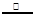 N2↑+2H2O。
N2↑+2H2O。
(4)步骤②通入氮气的目的是排除装置中的CO2。步骤④通入氮气的目的是将生成的CO2全部通入澄清石灰水中。
(5)由题意可知碳粉过量,产生的CO2为0.02mol,剩余的固体为3.76g,所以固体中有单质铁2.24g,则剩余的碳粉为3.76-2.24=1.52g,所以参加反应的碳粉为2-1.52=0.48g=0.04mol,则可以确定生成CO为0.02mol,因此方程式为:2C+Fe2O3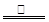 2Fe+CO↑+CO2↑。
2Fe+CO↑+CO2↑。
(6)①应将澄清石灰水换成Ba(OH)2溶液的原因是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全,M (BaCO3)>M(CaCO3),称量时相对误差小。②从环保的角度来看生成的CO也要处理掉,因此应该在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
点评:本题综合性较强,难度较大,主要考查学生分析问题和解决问题的能力。
本题难度:一般
5、选择题 人们对于化学科学有各种各样的认识,其中错误的是
[? ]
A.化学面对日益严重的环境问题显的无能为力,升学时考不考无关大局
B.化学是一门以实验为基础的自然科学,可以培养学生动手能力
C.化学是一门具有极强实用性的科学,应该予以重视
D.化学将在能源、资源的合理开发和安全应用方面大显身手
参考答案:A
本题解析:
本题难度:简单