1、实验题 (16分) 某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
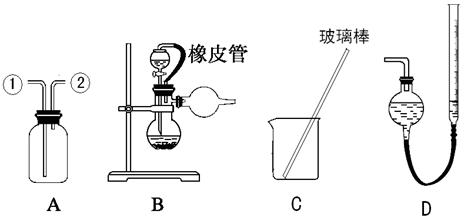

 【实验一】收集NO气体。
【实验一】收集NO气体。
 (1)用装置A收集NO气体,正确的操作是?(填序号)。
(1)用装置A收集NO气体,正确的操作是?(填序号)。
 a.从①口进气,用排水法集气? b.从①口进气,用排气法集气
a.从①口进气,用排水法集气? b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气? d..从②口进气,用排气法集气
c.从②口进气,用排水法集气? d..从②口进气,用排气法集气
 【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
(2)请参照装置A,画出净化Cl2装置图,标明所盛的药品,标注气体的流动方向。
【实验三】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑ 据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用NaOH溶液作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
(3) 选用?和?(填仪器标号)两个装置进行实验。
选用?和?(填仪器标号)两个装置进行实验。
(4) 测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=?。
测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=?。
(5) 计算镀层厚度,还需要检索的一个物理量是?。
计算镀层厚度,还需要检索的一个物理量是?。
(6) 若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将?(填“偏大”、“偏小”或“无影响”)。
若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将?(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g ;
;
(7)w(Zn)=?。
参考答案:(1)C?
(2)(4分)
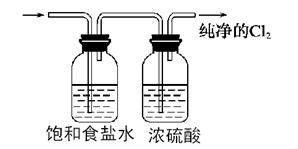
标注:饱和食盐水、浓硫酸、气流各1分,图中的导管的长短1分
(3)B和D?(各1分)(4)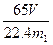 (或
(或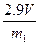 等其他合理答案:)
等其他合理答案:)
(5)金属锌的密度(或其他合理答案:)
(6)偏大
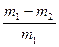 (或其他合理答案:)
(或其他合理答案:)
本题解析:略
本题难度:一般
2、实验题 (15分)某兴趣小组用题27图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
参考答案:
(1)4NH3+5O2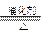 4NO+6H2O
4NO+6H2O
(2)放热
(3)浓硫酸;生成的NO与O2反应生成NO2;NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
(4)I;NH4Cl,与HCl反应生成氧气
本题解析:略
本题难度:简单
3、选择题 下列关于研究物质性质的基本程序,排列顺序正确是( )
a、观察物质的外观b、实验和观察c、解释及结论d、预测物质的性质.
A.bacd
B.adbc
C.abcd
D.dabc
参考答案:B
本题解析:
本题难度:一般
4、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2?(1)
平均反应速率的计算式为v(S2O82-)=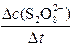 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-?(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
实?验?编?号
| ①
| ②
| ③
| ④
| ⑤
|
?
试剂
用量
(mL)
| 0.20? mol·L-1(NH4)2S2O8溶液
| 20.0
| 10.0
| ?b
| 20.0
| 20.0
|
0.20? mol·L-1 KI溶液
| 20.0
| 20.0
| 20.0
| 10.0
| 5.0
|
0.010? mol·L-1 Na2S2O3溶液
| ?a
| 8.0
| 8.0
| 8.0
| 8.0
|
0.2% 淀粉溶液
| 2.0
| 2.0
| 2.0
| 2.0
| 2.0
|
0.20? mol·L-1KNO3溶液
| 0
| 0
| 0
| 10.0
| ?c
|
0.20? mol·L-1(NH4)2SO4溶液
| 0
| 10.0
| 15.0
| 0
| 0
|
20 ℃时,反应时间Δt(s)
| 32
| 67
| 130
| 66
| 135
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变
|
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是?。
(3)第①组实验的v(S2O82-)=?mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)?
?。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
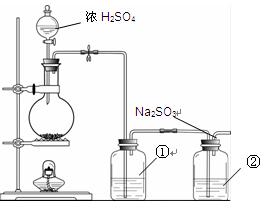
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①?;
②?。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是?。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:?。
参考答案:(13分)
I(1)a? 8.0?(1分)? b? 5.0?(1分)? c? 15.0?(1分)
(2)搅拌?(1分)?(3)2.5 × 10-5?(2分)(4)反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等(只答浓度对化学反应速率有影响不给分)?(1分)
II(1)①Na2S溶液、Na2CO3溶液(2分)②NaOH溶液…(不写溶液不得分)(1分)
(2)沉淀逐渐消失?(1分)?(3)加热浓缩,冷却结晶,过滤(2分)
本题解析:略
本题难度:简单
5、实验题 某同学进行实验研究时,欲配制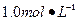 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
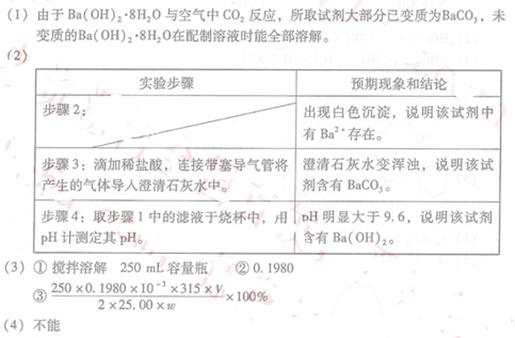
(1)烧杯中未溶物仅为BaCO3,理由是?
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管

(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250ml 约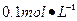 Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,?,将溶液转入?,洗涤,定容,摇匀。
Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,?,将溶液转入?,洗涤,定容,摇匀。
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 ??(填“0.020”、“0.05”、“0.1980”或“1.5”)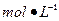 盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
③ 计算Ba(OH)2·8H2O的质量分数=?(只列出算式,不做运算)
(4)室温下,?(填“能”或“不能”) 配制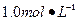 Ba(OH)2溶液。
Ba(OH)2溶液。
参考答案:
本题解析:略
本题难度:一般