1、选择题 下图是N2与H2反应生成NH3的过程中能量变化的曲线图:
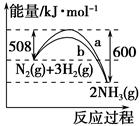
下列叙述正确的是( )。
A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热减小
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
参考答案:BD
本题解析:反应热的单位是kJ·mol-1,A错;加入催化剂可以降低活化能,故b较为合适,但是不能影响反应热,B对、C错;温度和体积一定的条件下,压强越大越有利于氨的合成,即氮气和氢气的转化率越大,放出的热量大于2Q1 kJ,小于184 kJ,D正确。
本题难度:一般
2、选择题 强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A.△H1>△H2>△H3
B.△H1<△H2<△H3
C.△H1<△H2=△H3
D.△H1=△H2<△H3
参考答案:C
本题解析:中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水放出大量的热,但放热越多,△H越小,因此答案选C。
点评:在判断反应热大小时,必须注意的是△H是含有符号的,即放热反应位“-”、吸热反应是“+”,所以放热越多,△H越小,据此可以判断。
本题难度:一般
3、选择题 下列五个化学方程式:
① C2H2(g) + H2(g)  C2H4(g);?② CH4(g)
C2H4(g);?② CH4(g)  ?H2(g) + C2H4(g),
?H2(g) + C2H4(g),
③ C(s) + 2H2(g)  CH4(g);△H=-x KJ· mol-1,
CH4(g);△H=-x KJ· mol-1,
④ C(s) + H2(g) 1/2C2H2(g);△H=-y KJ· mol-1,
1/2C2H2(g);△H=-y KJ· mol-1,
⑤ C(s) + H2(气)=1/2C2H4(g);△H=-z KJ· mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③至⑤式中x、y、z的大小顺序正确的是(? )
A.x >y>z
B.x>z>y
C.y>x>z
D.z
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列说法正确的是(?)
A.在外在条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.物质发生化学变化一定伴随着能量变化
D.据能量守恒定律,反应物的总能量一定等于生成物的总能量
参考答案:C
本题解析:略
本题难度:简单
5、选择题 以下各反应中,生成物的总能量高于反应物的总能量的是(?)
A.甲烷燃烧
B.Ba(OH)2·8H2O与NH4Cl反应
C.铝片与盐酸反应
D.氧化钙与水反应
参考答案:B
本题解析:生成物的总能量高于反应物的总能量,这说明该反应是吸热反应,选项ACD都是放热反应,B是吸热反应,答案选B。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识对巩固和训练,难度不大。该题的关键是记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。
本题难度:简单