1、选择题 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是(? )。
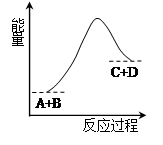
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
参考答案:B
本题解析:根据图像可知,反应物的总能量低于生成物的总能量,所以该反应是吸热反应,选项B正确,AC不正确。反应吸热反应还是放热反应,与反应条件无关系,只与反应物和生成物总能量的相对大小有关系,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练,有利于提高学生灵活运用基础知识解决实际问题的能力,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:简单
2、选择题 4P(红磷s)? =====? P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是:(?)
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
参考答案:A
本题解析:根据热化学方程式可知,红磷的能量低于白磷的,所以选项A正确;B不正确,应该是4mol红磷转变成白磷时吸收17kJ热量;C不正确,正反应是吸热反应;D不正确,红磷比白磷稳定,答案选A。
点评:对于物质来讲,特性的能量越低,物质是越稳定的,据此可以进行有关判断。
本题难度:一般
3、填空题 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是?。
(2)烧杯间填满碎纸条的作用是?。
(3)要重复进行三次实验的目的是?。
(4)大烧杯上如不盖硬纸板,求得的中和热数值?(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是_______?。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等、不相等”),所求中和热?(填“相等、不相等”),简述理由?。
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会?;(填“偏大、偏小、无影响”)。
(7)三次平行操作所测得的数据如下:
?温度
序号
| 起始温度t1/℃
| 终止温度
T2/℃
| 温度差
△t/℃
|
HCl
| NaOH
| 平均值
|
1
| 25
| 25
| ?
| 27.3
| ?
|
2
| 25
| 25
| ?
| 27.4
| ?
|
3
| 25
| 25
| ?
| 28.6
| ?
|
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C="4.18" J/(g·℃),则实验测得的中和热为?。
参考答案:(1)环形玻璃搅拌棒? (2分)
(2)隔热保温、减少实验过程中热量的损失?(2分)
(3)多次测量求平均值可以减少实验误差?(2分)
(4)偏小(1分);室温较低时反应体系向环境散热比较快,热量损失大,结果偏低(1分)
(5)不相等(1分),相等(1分),中和热是指酸与碱发生中和反应生成1molH2O时所放出的热量,与酸、碱的用量无关(2分)
(6)偏小(1分)
(7)39.3kJ/mol 或(△H= -39.3kJ/mol)?(2分)
本题解析:略
本题难度:简单
4、选择题 下列说法不正确的是
A.放热反应不需加热即可发生
B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等
C.需要加热才能进行的化学反应不一定是吸热反应
D.化学反应热效应数值与参加反应的物质多少有关
参考答案:A
本题解析:反应条件与反应是放热反应或吸热反应无关系,所以选项A不正确,其余都是正确的,答案选A。
本题难度:一般
5、填空题 (4分)氢气燃烧生成液态水的热化学方程式是:
2H2(g)+O2(g) ===2H2O(l)?ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和 (填“大于” 、“小于”或“等于”)反应物能量总和。
、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量?(填“>”、“<”或“=”)572 kJ。
参考答案:(4分)(1)小于?(2)<?(每空2分)
本题解析:略
本题难度:一般