1、简答题 有效地利用现有新能源和开发新能源已受到各国的重视.
(1)可用改进汽油组成的办法来改善汽油的燃烧性能.例如,在汽油中加入乙醇来生产“无铅汽油”.乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式______.
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一.能说明甲烷是正四面体而非正方形平面结构的理由是______.(填写编号,多选倒扣分)
①其一氯取代物不存在同分异构体? ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体?④其四氯取代物不存在同分异构体
(3)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.通入CH4的一极电极反应式是:CH4+10OH--8e-=CO32-+7H2O;通入O2的一极,其电极反应式是______.已知4g甲烷完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则甲烷燃烧的热化学方程式为______;
(4)氢能是人类未来的理想能源.1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列既可供开发又消耗较低经济的制氢方法是______(填写编号,多选倒扣分)
①电解水? ②锌和稀硫酸反应? ③光解海水
其次,制得纯氢气后,还需要解决的问题是______.(写出其中的一个)
参考答案:(1)根据碳的四价键结构、氧的二价键架构,C2H6O所有可能的结构简式为CH3CH2OH或CH3OCH3,
故答案为:CH3CH2OH、CH3OCH3;
(2)天然气的主要成分是甲烷,根据分子式,可推测CH4的空间结构只有平面正方形和正四面体两种可能.若为平面正方形结构,则其二元取代物有两种同分异构体,而正四面体的二元取代物不存在同分异构体,故答案为:②;
(3)①负极反应式为:CH4-8e-+10OH-=CO32-+7H2O,用总反应式减去负极反应式得正极反应式:
?O2+4e-+2H2O═4OH-,甲烷的摩尔质量是16,4g甲烷完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,16g放出的热量为:222.5kJ×4=890kJ;
故答案为:2O2+4H2O+8e-=8OH-(或O2+2H2O+4e-=4OH-)CH4(g)+2O2?(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
(4)电解水消耗大量的电能,锌和硫酸反应也不符合工业上大量生产,只有利用太阳能使海水光解才是最经济的方法,
氢气储存和运输时容易爆炸,故答案为:③贮存或运输.
本题解析:
本题难度:一般
2、选择题 电浮选凝聚法处理酸性污水的工作原理如图所示.下列说法不正确的是( )
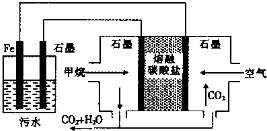
A.铁电极的电极反应式为:Fe-2e-═Fe2+
B.通人空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-
C.若左池石墨电极产生44.8L(标准状况)气体,则消耗氧气0.5mol
D.为增强污水的导电能力,可向污水中加入适量工业用食盐
参考答案:A.通入氧气的电极上得电子发生还原反应,所以通入氧气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+,故A正确;
B.通入空气的电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,故B正确;
C.石墨电极上析出的气体为氢气,生成44.8L氢气转移电子的物质的量=44.8L22.4L/mol×2=4mol,根据转移电子相等得,消耗氧气的物质的量=4mol4=1mol,故C错误;
D.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质,故D正确;
故选C.
本题解析:
本题难度:简单
3、选择题 铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O下列结论正确的是( )
A.Pb为正极被氧化
B.SO 只向PbO2极移动
只向PbO2极移动
C.电解质溶液密度不断减小
D.溶液的pH值不断减小
参考答案:C
本题解析:A.由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,Pb为负极,发生失电子的氧化反应,被还原,故A错误;
B、原电池中阳离子向正极移动,阴离子硫酸根向负极Pb极移动,故B错误;
C、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,电解质溶液密度不断减小,故C正确;
D、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,pH不断增大,故D错误.
故选C。
点评:本题考查原电池的工作原理,题目难度中等,本题注意电极反应式的书写,为解答该题的关键。
本题难度:一般
4、选择题 已知反应AsO43-+2I-+2H+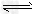 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%?NaOH溶液
结果发现电流计指针均发生偏转。据此,下列判断正确的是
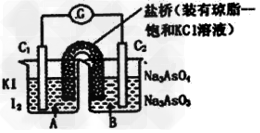
[? ]
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O
D.Ⅱ操作过程中,C1棒上发生的反应为:2I-―2e-=I2
参考答案:C
本题解析:
本题难度:一般
5、选择题 电瓶车所用电池一般为铅蓄电池,是一种典型的可充电电池(如图所示),电池总反应式为PbSO4+2H2O Pb+PbO2+4H++2SO42-。则下列说法正确的是
Pb+PbO2+4H++2SO42-。则下列说法正确的是
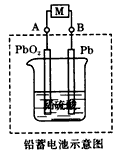
[? ]
A.放电时,电流方向由B过M到A
B.放电时,负极反应是Pb-2e-+SO42-= PbSO4
C.充电时,铅蓄电池的正极应与充电器电源的负极相连
D.充电时,阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+
参考答案:BD
本题解析:
本题难度:一般