1、简答题 下表标出的是元素周期表的一部分元素,回答下列问题
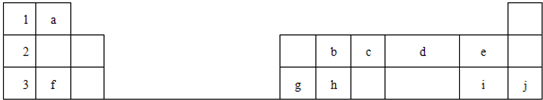
(1)表中列出的10种元素中,化学性质最不活泼的是______(填元素名称,下同),非金属性最强的是______,原子半径最小的是______.
(2)分子bd2的电子式______,元素e的负一价阴离子的结构示意图______.
(3)物质bd2和hd2在物理性质上有着巨大差异,其原因是物质bd2属于______晶体,物质hd2属于______晶体.
(4)元素e的气态氢化物比元素i的气态氢化物______(填“稳定”或“不稳定”)
(5)元素f、g的最高价氧化物对应水化物之间反应的离子方程式是______;
(6)物质fda含有的化学键类型是______.
2、推断题 现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素符号:B__________,C__________;
(2)画出A2-的离子结构示意图:__________, 指出D在周期表的位置:__________;
(3)写出B的呈淡黄色的化合物与CO2反应的化学方程式:___________________________;
(4)比较D的气态氢化物与H2S和HF的稳定性:____________________(用化学式表示);
(5)用电子式表示C与D形成化合物的过程:____________________。
|
3、推断题 六种元素A、B、C、D、E、F的原子序数依次增大,且A、B、C、D、E、F均为短周期元素,B与A能以1∶1、1∶2或1∶3等形成多种常见化合物;C与D相邻,D与F元素位于同一主族;D与E能以1∶1或1∶2形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其结构式是____________________.
(2)A、D、F元素中形成的两种双核阴离子,在溶液中反应的离子方程式为________________________.
(3)E与F形成的化合物的电子式为________________________,该化合物的水溶液显碱性,原因是(用离子方程式表示)______________________________,用惰性电极电解该化合物的水溶液时,有固体析出,反应化学方程式为______________________________________.
4、选择题 各组性质比较的表示中,正确的是( )
A.酸性:HI<HBr<HCl<HF
B.稳定性:HF<HCl<HBr<HI
C.氧化性:F2<Cl2<Br2<I2
D.沸点:F2<Cl2<Br2<I2
5、选择题 短周期元素A、B、C、D在周期表中的位置如图所示,若A的原子序数为a、最外层电子数为n,则下列关系式或说法错误的是( )
A.四种元素的原子序数之和Z=4a+16
B.四种元素的原子序数之和Z≤50
C.四种元素的最外层电子数之和E=4n+2
D.四种元素的最外层电子数之和E≤30